
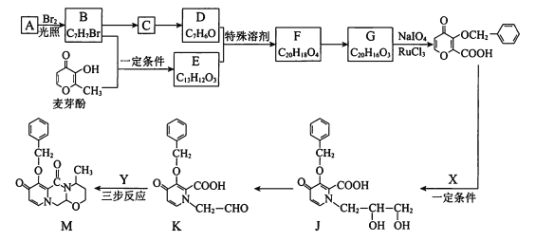
【题目】度鲁特韦可以用于治疗HIV-1感染,M是合成度鲁特韦的一种中间体。合成M的路线如下:(部分反应条件或试剂略去)
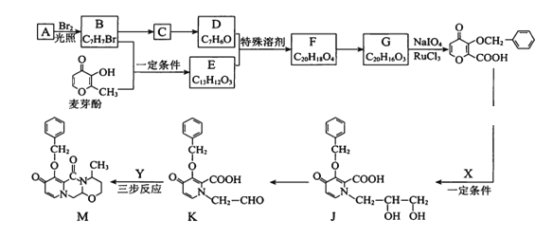
己知:
Ⅰ.![]()
Ⅱ.![]()
Ⅲ.![]()
(1)麦芽酚中含有官能团的名称是羰基、醚键、_______和______。
(2)A是苯的同系物,A—B的反应类型是_____。
(3)B- C的反应条件是____。
(4)C-D的化学方程式是_______。
(5)E不能与金属Na反应生成氢气,麦芽酚生成E的化学方程式是_______。
(6)G的结构简式是_____。
(7)X的分子式为C3H9O2N,X的结构简式是_______。
(8)Y的分子式为C4H11ON,Y与X具有相同种类的官能团,下列说法正确的是_______。
a.Y与X互为同系物
b.Y能与羧酸发生酯化反应
c.Y在浓硫酸、加热的条件下能发生消去反应
(9)K-M转化的一种路线如下图,中间产物2的结构简式是_______。

【答案】碳碳双键 羟基 取代反应 NaOH水溶液,加热 ![]()
![]()
![]() bc
bc 
【解析】
A为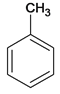 ,在光照条件下与溴发生取代反应生成B
,在光照条件下与溴发生取代反应生成B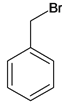 ,在NaOH的水溶液中水解生成C
,在NaOH的水溶液中水解生成C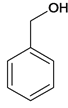 ,C氧化后生成D
,C氧化后生成D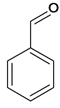 ,根据信息I,D与E
,根据信息I,D与E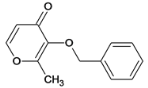 发生加成反应生成F
发生加成反应生成F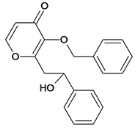 ,F发生消去反应生成G
,F发生消去反应生成G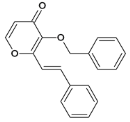 ,根据信息Ⅱ,G在NaIO4,RuCl3作用下生成
,根据信息Ⅱ,G在NaIO4,RuCl3作用下生成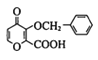 ,
, 在一定条件下与
在一定条件下与![]() 反应生成J转化成K,最终与Y经三步反应得产品M。
反应生成J转化成K,最终与Y经三步反应得产品M。
(l)麦芽酚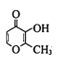 中含有官能团的名称是羰基、醚键、碳碳双键和 羟基;
中含有官能团的名称是羰基、醚键、碳碳双键和 羟基;
(2)A是苯的同系物,A为 ,在光照条件下与溴发生取代反应生成B
,在光照条件下与溴发生取代反应生成B ;
;
(3) B 在NaOH的水溶液中水解生成C
在NaOH的水溶液中水解生成C ,B→ C的反应条件是NaOH水溶液,加热。
,B→ C的反应条件是NaOH水溶液,加热。
(4)C氧化后生成D ,C-D的化学方程式是
,C-D的化学方程式是![]() 。
。
(5)E不能与属Na反应生成氢气,麦芽酚生成E的化学方程式是![]() 。
。
(6)F发生消去反应生成G ,G的结构简式是
,G的结构简式是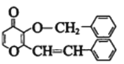 。
。
(7)结合J和X的分子式为C3H902N,X的结构简式是![]() 。
。
(8)结合K、M、Y的分子式为C4H11ON,Y与X具有相同种类的官能团,Y为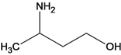 ,a 、X有两个羟基, Y与X不是互为同系物,错误;b Y含有羟基能与羧酸发生酯化反应,正确;c Y羟基的邻碳上有氢,在浓硫酸、加热的条件下能发生消去反应,正确;故选bc。
,a 、X有两个羟基, Y与X不是互为同系物,错误;b Y含有羟基能与羧酸发生酯化反应,正确;c Y羟基的邻碳上有氢,在浓硫酸、加热的条件下能发生消去反应,正确;故选bc。
(9)K→M转化的一种路线如图,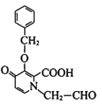 与
与 氨基上一个氢与羧基脱去一分子水,得中间产物1,氨基与醛基加成,得中间产物2的结构简式是
氨基上一个氢与羧基脱去一分子水,得中间产物1,氨基与醛基加成,得中间产物2的结构简式是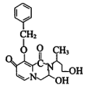 ,中间产物2两个羟基再失去一分子水得M。
,中间产物2两个羟基再失去一分子水得M。


科目:高中化学 来源: 题型:
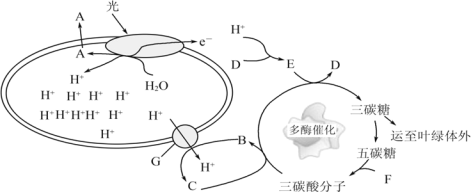
【题目】(下图为某植物的光合作用过程模式图,字母 A-G 表示物质或结构,二烷氨基乙醇羧酸脂(DA-6)是一种新型的叔胺类植物生长调节剂。某科研小组研究了 DA-6 对西瓜光合作用的影响,其相关指标测定(Rubisco 是碳反应的关键酶)结果如下表:
D A - 6 对西瓜光合作用的影响实验结果记录表
组 别 | 处理 | 光合速率 | 气孔导度 | 胞间二氧化碳浓度 | Rubisco 活性 |
(mmolm-2s-1) | (mmolm-2s-1) | (mmolm-2s-1) | (umolm-2s-1) | ||
① | 不遮光+清水 | 10.1 | 0.16 | 260 | 38.2 |
② | 不遮光+DA-6 | 15.2 | 0.24 | 255 | 42.1 |
③ | 遮光+清水 | 8.3 | 0.14 | 278 | 25.3 |
④ | 遮光+DA-6 | 13.4 | 0.23 | 269 | 35.7 |
(1)图中产生物质 A 的结构是___________________________,D 物质为___________________________。
(2)据图推测类囊体腔中积累H+的生理意义最可能是___________________________。
(3)突然停止光照,短期内三碳酸分子的含量将会___________________________。
(4)胞间 CO2 进入叶绿体内参与卡尔文循环,该过程生成 3 个 RuBP 需消耗___________________________个三碳糖磷酸,RuBP 的元素组成为__________________________。
(5)气孔导度表示气孔开放的程度。该研究能说明气孔导度不是遮光条件下光合速率下降的主要限制因素,可以证明此结论的实验组别是___________
A.① ② B.① ③ C.③ ④ D.② ④
(6)DA-6 可提高西瓜叶片的光合速率。从表数据进行推测,DA-6 提高西瓜叶片光合速率作用机制是:DA-6 通过__________________________,从而提高光合作用的速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性: ![]() >H2CO3>
>H2CO3>![]() >HCO3-;现要将
>HCO3-;现要将![]() 转变为
转变为 ![]() ,可行的方法是
,可行的方法是
A.向该溶液中加入足量的稀硫酸,加热
B.将该物质与稀硫酸共热后,再加入足量的NaOH溶液
C.将该物质与足量的NaOH溶液共热,再通入足量CO2气体
D.将该物质与稀硫酸共热后,再加入足量的Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式为
A.用醋酸除去水垢:2H++CaCO3![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
B.硫化亚铁与浓硫酸混合加热:2H++FeS![]() H2S↑+Fe2+
H2S↑+Fe2+
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO32-![]() Al2(CO3)3↓
Al2(CO3)3↓
D.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)燃料电池是一种高效、环境友好的发电装置。氢氧燃料电池已用于航天飞机。以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为________,这种电池在放电使用一段时间后,电解质溶液中的c(OH-)将____(填“增大”“减小”或“不变”)。
(2)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:
锌为____极,该电极上发生_______反应(“氧化”或“还原”),电极反应式为___________,该原电池的总反应离子方程式为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰水杨酸是一种常见的解热镇痛药,结构简式如图所示。下列有关叙述正确的是

A.乙酰水杨酸的分子式为C9H10O4
B.乙酰水杨酸的含氧官能团有三种
C.能与NaHCO3溶液反应的官能团有一种
D.烃基(C4H9)取代乙酰水杨酸苯环上的氢原子,最多能形成4种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用。回答下列问题:
I.实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3)。
(1)盐酸和NaClO3反应时有ClO2和Cl2生成,书写反应的离子方程式并标出电子转移的方向和数目______________________________________,当反应中转移0.2mol电子时,参加反应的还原剂的物质的量为________________________________。
(2)使用双氧水作还原剂的优点是_________________________________________。
II.当pH≤2.0时,NaClO2能被I 完全还原成Cl;(离子反应方程式为ClO2+4H++4I→2I2+Cl+2H2O)。回答下列问题:
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6(2Na2S2O3+I2→2NaI+Na2S4O6)。欲测定成品中NaClO2的含量,现进行如下操作:
步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节pH≤2.0 |
步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定发生反应 |
(1)步骤Ⅱ加入指示剂的名称是_______________。滴定终点时溶液的颜色变化为_________。
(2)若上述滴定操作中平均消耗VmL Na2S2O3标准溶液,则成品中NaClO2的质量分数为__________(用含W、c、V的代数式表示)。
(3)ClO2和Cl2均能将电镀废水中的CN 氧化为无毒的物质,自身被还原为Cl,处理含相同量CN的电镀废水,所需Cl2的物质的量是ClO2的___倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
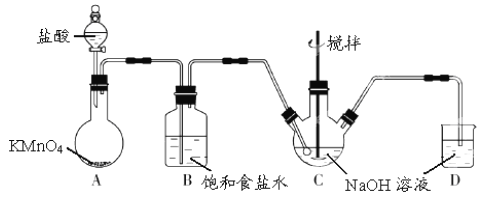
【题目】I.KMnO4 是一种氧化剂,实验室常用 KMnO4和浓盐酸反应制备 Cl2。下图是制备 NaClO溶液的装置图。
完成下列填空:
(1)KMnO4 稀溶液是一种常见消毒剂,其消毒机理与以下物质相似的是______(选填编号)。
a.75%酒精 b.双氧水 c.NaClO 溶液 d.硫磺皂
(2)B装置中饱和食盐水的作用是___________,D装置中NaOH的作用是______________。
(3)实验操作过程中可调节__________以控制A 装置中产生 Cl2 的气流,C装置需控制反应温度在 0~5℃,实验中可将C 装置放入________________中。
II.测定 KMnO4纯度可用标准 Na2S2O3(式量—158)溶液进行滴定,反应离子方程式为:8MnO4-+5S2O32-+14H+→10SO42-+8Mn2++7H2O。
(4)配制250 mL 0.1000 mol/L标准 Na2S2O3溶液,需准确称取Na2S2O3固体的质量为____g。
(5)取某 KMnO4(式量-158) 产品 0.600g,酸化后用 0.1000 mol/L 标准 Na2S2O3溶液进行滴定,滴定至终点消耗 Na2S2O3溶液 20.00 mL,则该 KMnO4 产品的纯度是_________(保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应过程中能量变化的说法正确的是

A. 图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化
B. 己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2
C. 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D. 在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com