
【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
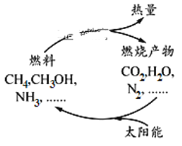
(1)在上图构想的物质和能量循环中太阳能最终转化为____________能。
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH,该反应的化学方程式为:2CO2(g)+4H2O(g)![]() 2CH3OH(g)+3O2(g)。
2CH3OH(g)+3O2(g)。
一定条件下,在2 L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
①用CH3OH表示0~3 min内该反应的平均反应速率为______________________。
②能说明该反应已达到平衡状态的是_______________。
a.v正(H2O)=2v逆(CO2) b.n(CH3OH):n(O2)=2:3
c.容器内密度保持不变 d.容器内压强保持不变
(3)我国科学家用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
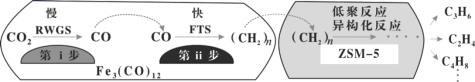
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如表。

①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加____________助剂效果最好;
②加入助剂能提高单位时间内乙烯产量的根本原因是____________。
(4)用人工光合作用得到的甲醇、氧气和稀硫酸制作电池,则甲醇应通入该电池的____极(填“正”或“负”),溶液中的H+流向该电池的____极(填“正”或“负”)通入氧气的一极的电极反应式为_______________。
【答案】热 0.015 mol/(Lmin) ad K 加快乙烯生成速率,而对其他副反应几乎无影响 负 正 O2+4H++4e-=2H2O
【解析】
(1)光合作用下生成燃料,燃料燃烧释放出能量;
(2)①根据表中数据可知,5 min后达到平衡状态,甲醇的物质的量为0.100 mol,利用3 min时甲醇的物质的量,结合容器的容积计算其物质的量的浓度,再根据v=![]() 计算用甲醇表示0~3 min内该反应的平均反应速率;
计算用甲醇表示0~3 min内该反应的平均反应速率;
②可逆反应达到平衡时,正、逆反应速率相等,各物质的浓度、含量不变,甲醇判断;
(3)①结合图表数据分析三种助剂对CO2转化率和乙烯在产物中的百分比分析;
②根据助剂起催化作用,结合催化剂在反应中的作用分析;
(4)该原电池中,通入燃料甲醇的电极是负极、通入氧气的电极是正极;甲醇失去电子生成二氧化碳气体,氧气得到电子与溶液中H+结合形成水;溶液中阳离子向正极定向移动,阴离子向负极定向移动。
(1)由据图可知,太阳能首先转化为化学能,然后再由化学能转化为热能,故太阳能最终能量转化形式为热能;
(2)①根据表中数据可知,3 min时甲醇的物质的量为0.09 mol,由于容器的容积是2 L,反应时间是3 min,故用甲醇表示的反应速率v(CH3OH)=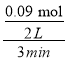 =0.015 mol/(Lmin);
=0.015 mol/(Lmin);
②a.v正(H2O)=2v逆(CO2) 可说明正、逆反应速率相等,达到平衡状态,a正确;
b.在任何条件下都存在关系n(CH3OH):n(O2)=2:3,因此无法判断各组分的浓度是否继续变化,则无法判断是否达到平衡状态,b错误;
c.因气体的体积以及质量不变,则容器内密度保持不变,不能用于判断是否达到平衡状态,c错误;
d.反应前后气体的体积不等,容器内压强为变量,但容器内压强保持不变,可说明达到平衡状态,d正确;
故合理选项是ad;
(3)①结合图表数据分析可知加钠时CO2转化率最大,但乙烯在产物中百分比太低,副产物过多,加铜时乙烯在产物中的百分比最大,但CO2转化率却太低,综合考虑加K时转化率不算低,同时乙烯在产物中的百分比较高。故欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加K助剂效果最好;
②助剂本身也起催化作用,而催化剂在反应过程中可以降低反应的活化能,从而加快反应速率,因此助剂可以起到降低生成乙烯的反应所需要的活化能,加快乙烯生成速率,而对其他副反应几乎无影响;
(4)在反应中甲醇被氧化,故通入甲醇的电极应为电池的负极,正极上氧气得到电子发生还原反应,则通入氧气的一极为正极,氧气被还原生成水,正极的电极反应式为:O2+4H++4e-=2H2O。根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中的H+向负电荷较高的正极定向移动。


科目:高中化学 来源: 题型:
【题目】Ⅰ.CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2 4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的量应该是______________。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率_______
Ⅱ.氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。完成下列计算:
(5)CaCO3质量分数为0.90的石灰石100 kg完成分解产生CO2_______L(标准状况)。石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为_______mol。
(6)已知粗盐水含MgCl2 6.80 mol/m3,含CaCl2 3.00mol/m3。向粗盐水中加入Ca(OH)2除镁离子:MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2然后加入Na2CO3除钙离子。处理上述粗盐水10 m3,至少需要加Na2CO3______g。如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应:Ca2+ + 2NH3 + CO2 + H2O → CaCO3↓ + 2NH4+处理上述10 m3粗盐水至少需要通入_____________L(标准状况)碳酸化尾气。
(7)某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070 kg。
①过滤后溶液中氯化钠的质量______________。
②析出的碳酸氢钠晶体的质量__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表格中的各种情况,可以用右图的曲线表示的是 ( )
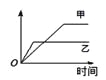
反 应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量的氨,在同一容器中 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
C | 在体积可变的恒压容器中,体积比1︰3的N2、H2, | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
D | 2 molSO2和1 molO2,在相同温度下2SO2+ O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为____________。
②下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液
c 加水稀释 d 加入少量醋酸钠晶体
(2)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
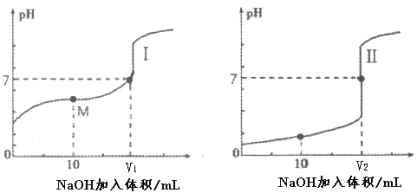
①滴定醋酸的曲线是___________(填“I”或“Ⅱ”)。
②滴定开始前,0.1 mol·L-1 NaOH、0.1 mol·L-1的盐酸和0.1 mol·L-1醋酸三种溶液中由水电离出的c(H+)最大的是_______溶液。
③图I中,V=10时,溶液中的c(H+)_________c(OH-) (填“>”、“=”或“<”,下同),c(Na+)_________c(CH3COO-)。
(3)下表为某同学所测25℃时,甲、乙两种溶液的pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =___________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸反应,消耗的盐酸体积:甲_____乙。
③甲、乙溶液均加水稀释10倍后,所得溶液的pH:甲_____乙。
(4)煤炭工业中经常会产生大量SO2,为防止污染环境,常采用吸收法进行处理。以下物质可用于吸收SO2的是____________。
A H2O2 B Na2CO3 C Na2SO3 D Ca(OH)2
(5)下表是几种常见弱酸的电离常数
化学式 | CH3COOH | H2SO3 | HClO | H2CO3 |
电离 常数 | 1.8×10-5 | K1=1.23×10-2 K2=6.6×10-8 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
/span>
以下反应对应的离子方程式正确的是___________。
A Na2CO3溶液吸收少量SO2:CO32-+SO2+H2O = SO32-+HCO3-
B 漂白液生效的原理:ClO-+CO2+H2O = HClO+HCO3-
C 次氯酸钠溶液吸收少量SO2:ClO-+SO2+H2O = HClO+SO32-
D 醋酸除水垢中的CaCO3:2CH3COOH+CaCO3 = Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分属周期表前三周期的四种元素W、X、Y、Z可形成结构如图的物质,该物质中所有原子均满足稳定结构,W的原子序数最大,Y、Z处于同一周期。下列说法错误的是( )
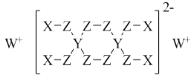
A.在该物质中,Y的化合价为+4价
B.X和Z可以形成具有强氧化性的化合物
C.由Z和W形成的化合物中可以存在共价键
D.X、Y、Z的原子半径从大到小为Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态电子排布式可表示为________。
(2)MX![]() 的空间构型是________(用文字描述)。
的空间构型是________(用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是_________________________________。
(4)根据等电子原理,WX分子的结构式为________。
(5)1 mol WX2中含有的σ键数目为________。
(6)H2X分子中X原子轨道的杂化类型为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面所写的有机反应方程式及其类型都正确的是 ( )
A.![]() +HNO3
+HNO3![]()
![]() +H2O 取代反应
+H2O 取代反应
B.2CH3CHO+O2 ![]() 2CH3COOH 氧化反应
2CH3COOH 氧化反应
C.CH2=CH2+Br2 → CH3CHBr2 加成反应
D.HCOOCH3CH2+H2O ![]() HCOOH+CH3CH2OH 取代反应
HCOOH+CH3CH2OH 取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )
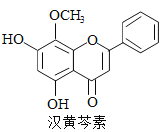
A. 汉黄芩素的分子式为C16H13O5
B. 该物质遇 FeCl3 溶液显紫色
C. 1mol 该物质与溴水反应,最多消耗5 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少1 种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com