
A、已知 ,反应物X与产物Y互为同分异构体,可用溴水或FeBr3溶液鉴别X和Y ,反应物X与产物Y互为同分异构体,可用溴水或FeBr3溶液鉴别X和Y |
B、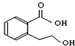 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 |
| C、3-甲基-3-乙基戊烷的一氯取代产物为5种 |
| D、相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大 |
 分子中含有苯环、-COOH、-OH,能发生加成反应、取代反应、消去反应、酯化反应,不能发生水解反应,故B错误;
分子中含有苯环、-COOH、-OH,能发生加成反应、取代反应、消去反应、酯化反应,不能发生水解反应,故B错误;

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )| A、1:1 | B、2:1 |
| C、3:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W四种物质之间有如右图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式:△H=△H1+△H2,符合上述要求的X、Y可能是①S、SO2 ②AlCl3、Al(OH)3 ③CH2=CH2、CH3CH3 ④CH3OH、HCHO.
X、Y、Z、W四种物质之间有如右图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式:△H=△H1+△H2,符合上述要求的X、Y可能是①S、SO2 ②AlCl3、Al(OH)3 ③CH2=CH2、CH3CH3 ④CH3OH、HCHO.| A、①② | B、②③ | C、②④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将pH试纸直接放在某溶液中,测试该溶液的pH |
| B、分液操作时,先将下层液体从下口放出,然后再换个烧杯将上层液体从下口放出 |
| C、过滤操作时,漏斗下端的尖嘴要紧靠烧杯的内壁 |
| D、用乙醇作萃取剂从碘水中提取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、分子式为C23H38O7 |
| B、能使酸性KMnO4溶液、溴水褪色 |
| C、能发生酯化、水解、加成、消去、还原、氧化、加聚、缩聚反应 |
| D、相对分子质量较小的水解产物的同类同分异构体还有3种(不包括本身,不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃烧化石燃料排放的废气中含有大量SO2,易形成酸雨 |
| B、为防止垃圾污染城市,可采用露天焚烧或深埋的方法进行处理 |
| C、含氮、磷化合物的生物污水大量排放会使水体富营养化 |
| D、PM2.5指大气中直径小于或等于2.5微米的颗粒物,它对空气质量和能见度等有重要的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将浓度为0.1 mol?L-1HF溶液加水不断稀释过程中,c(H+)和c(OH-)都会减小 |
| B、25℃时,等体积、等pH的HCl、H2SO4、CH3COOH溶液分别与足量锌粉反应,H2SO4溶液产生的H2量最多 |
| C、Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-,加入NaOH固体会使平衡逆向移动,溶液pH减小 |
| D、25℃时,pH均为8的CH3COONa和NaOH溶液中,由水电解产生的c(OH-)之比为100:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一密闭容器中加入相同物质的量的X和Y气体,发生反应:X(g)+Y(g)?3Z(g).分别在100℃和300℃反应时Z的体积分数Z%随时间t变化如图所示.已知在t3时改变了某一反应条件.则相关判断正确的是( )
一密闭容器中加入相同物质的量的X和Y气体,发生反应:X(g)+Y(g)?3Z(g).分别在100℃和300℃反应时Z的体积分数Z%随时间t变化如图所示.已知在t3时改变了某一反应条件.则相关判断正确的是( )| A、曲线b表示的是l00℃时的图象 |
| B、该反应的正反应是吸热反应 |
| C、t2时,曲线a、b对应反应速率v(a)>v(b) |
| D、t3时改变的条件可能是增大了压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、D、E、X、Y是原子序数依次增大的短周期主族元素.其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用.
A、D、E、X、Y是原子序数依次增大的短周期主族元素.其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com