
| A、在结冰的路面上撒盐,是利用盐与水发生化学反应放出大量热量,促使冰雪融化 |
| B、我国决定推广使用车用乙醇汽油,乙醇汽油是一种新型的化合物,属于可再生能源 |
| C、利用可降解的生物质材料“玉米塑料”(主要成分为聚乳酸)替代一次性饭盒,可防止产生白色污染 |
| D、氮化硅陶瓷可用于制造新型柴油发动机是因为氮化硅陶瓷具有较大的硬度 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
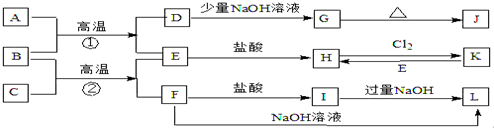
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4 |
| B、C3H4 |
| C、C3H6 |
| D、C6H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.l mol/L醋酸钙溶液中,c(Ca2+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、体积和pH都相同的NH4Cl溶液、盐酸,完全溶解少量且等质量的锌粉,前者所用时间少 |
| C、将n mol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D、某物质的溶液中由水电离出的c(H+)=1×10-a mol?L-1,若a>7时,则该溶液的pH一定为14-a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
| C、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| D、纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A、0.1 mol?L-lNaHCO3溶液中各离子浓度的大小顺序为:c( Na+)>c(HCO3-)c(HJ-)>c(OH-) |
| B、少量的CO2通人到NaCN溶液中:CN-+H2O+CO2═HCN+HCO3- |
| C、用0.1 mol?L-l NaOH溶液中和等浓度的HCN溶液和HCOOH溶液时,前者所需NaOH溶液体积大 |
| D、相同体积的0.1 mol?L-l HCOONa溶液比0.1 mol?L-l NaCN溶液所含离子总数小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
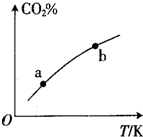 向某恒容密闭容器中充入一定量C02和H:,发生反应:CO2(g)+H2(g)?HCOOH(g)测得平衡体系中C02的百分含量(CQ%)与反应温度变化的关系如图所示.下列物理量 中,a点大于b点的是 ①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数( )
向某恒容密闭容器中充入一定量C02和H:,发生反应:CO2(g)+H2(g)?HCOOH(g)测得平衡体系中C02的百分含量(CQ%)与反应温度变化的关系如图所示.下列物理量 中,a点大于b点的是 ①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数( )| A、①② | B、①③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 按要求对图中两极进行必要的联接并填空:
按要求对图中两极进行必要的联接并填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com