
| 实验 编号 | 实验目的 | T/K | pH | c/10-3 mol/L | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
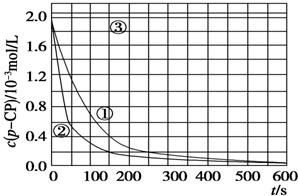 [数据处理]
[数据处理]分析 (1)对比实验的基本思想是控制变量法,可以在温度相同时,变化浓度,或者在浓度相等时,变化温度;
(2)根据反应速率公式V=$\frac{△c}{△t}$计算平均反应速率;
(3)根据过氧化氢在温度较高时易分解的角度分析;
(4)根据曲线③中溶液pH对反应速率的影响角度判断改变的反应条件.
解答 解:(1)对比实验的关键是控制变量,实验②探究温度对降解反应速率的影响,则②中除了温度不同以外,其它量必须与实验①相同,则温度、双氧水浓度、亚铁离子浓度分别为:313K、6.0、0.30;实验③中除了pH与①不同外,其它量完全相同,则探究的是溶液的pH对降解反应速率的影响,
故答案为:
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 313 | 3 | 6.0 | 0.30 | |
| ③ | 探究溶液的pH对降解反应速率的影响 | ||||
点评 本题考查化学反应速率的影响因素,题目难度中等,注意掌握影响化学反应速率的因素,明确设计对比实验时,只能改变一个条件,否则无法确定影响因素,试题培养了学生的分析、理解能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 2,3,4 | B. | 4,3,2 | C. | 4,2,3 | D. | 3,2,4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L HR溶液与0.1mol/L氨水等体积反应,所得溶液呈酸性 | |
| B. | NaR晶体用蒸馏水配成水溶液,PH试纸测得PH大于7 | |
| C. | 将PH=2.3的HR溶液加蒸馏水稀释10倍,PH变成2.8 | |
| D. | 常温下,0.1mol/L HR溶液的pH为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大容器体积 | B. | 通入大量O2 | C. | 移去部分SO2 | D. | 降低体系温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com