
【题目】按要求完成下列空格
Ⅰ.为减少SO2的排放,常采取以下措施,将煤转化为清洁的气体燃料。已知:
①H2(g)+![]() O2(g)=H2O(g) ΔH1=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8kJ·mol-1
②C(s)+![]() O2(g)=CO(g) ΔH2=-110.5kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式____________。
Ⅱ.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g) +B(g) ![]() xC(g) +2D(g),经5min后,测得D的浓度为0.5molL﹣1,C的平均反应速率是0.1mol/(Lmin),且此时A的物质的量浓度为0.25molL﹣1。
xC(g) +2D(g),经5min后,测得D的浓度为0.5molL﹣1,C的平均反应速率是0.1mol/(Lmin),且此时A的物质的量浓度为0.25molL﹣1。
(1)x的值是_____;
(2)B的平均反应速率_____;
(3)则反应开始前放入容器中A的物质的量_____。
Ⅲ.(1)CO2,NaCl,Na,Si,CS2,五种物质的熔点由高到低的顺序是________(用分子式或化学式表示)。
(2)A、B、C、D为四种晶体,性质如下:
A固态时能导电,能溶于盐酸;B能溶于CS2,不溶于水;
C固态时不导电,液态时能导电,可溶于水;D固态、液态时均不导电,熔点为3500 ℃;
试推断它们的晶体类型:A_____;B_____;C_____;D_____。
(3)磷和氯气反应可生成组成比为1∶3的化合物,该化合物的立体构型为_____,中心原子的杂化轨道类型为_____,中心原子的价层电子对数为_____。
【答案】C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ·mol-1 2 0.05mol/(Lmin) 2mol Si>NaCl>Na>CS2>CO2 金属晶体 分子晶体 离子晶体 原子晶体 三角锥形 sp3 4
【解析】
I.(1)根据盖斯定律分析解答;
Ⅱ.根据υ=![]() 计算υ(D),再根据反应速率之比等于化学计量数之比分析解答;
计算υ(D),再根据反应速率之比等于化学计量数之比分析解答;
Ⅲ.(1)一般而言,物质的熔点由高到低的顺序为原子晶体>离子晶体>分子晶体,据此分析排序;
(2)根据晶体的物理性质分析判断;
(3)根据价层电子对数=σ键电子对数+孤电子对数=σ键电子对数+![]() (a-xb)计算判断。
(a-xb)计算判断。
I.①H2 (g)+![]() O2 (g)=H2O(g) △H=-241.8 kJ/mol,②C (s)+
O2 (g)=H2O(g) △H=-241.8 kJ/mol,②C (s)+![]() O2 (g)=CO (g) △H=-110.5kJ/mol,根据盖斯定律,将②-①可得C(s)+H2O(g)=CO(g)+H2(g) △H=(-110.5kJ/mol)-(-241.8kJ/mol)=+13l.3 kJ/mol,故答案为:C(s)+H2O(g)=CO(g)+H2(g) △H=+13l.3 kJ/mol;
O2 (g)=CO (g) △H=-110.5kJ/mol,根据盖斯定律,将②-①可得C(s)+H2O(g)=CO(g)+H2(g) △H=(-110.5kJ/mol)-(-241.8kJ/mol)=+13l.3 kJ/mol,故答案为:C(s)+H2O(g)=CO(g)+H2(g) △H=+13l.3 kJ/mol;
Ⅱ.(1)经5min后,测得D的浓度为0.5molL-1,则υ(D)=![]() =0.1mol/(Lmin),C的平均反应速率是0.1mol/(Lmin),则:0.1mol/(Lmin)∶0.1mol/(Lmin)=2∶x,解得x=2,故答案为:2;
=0.1mol/(Lmin),C的平均反应速率是0.1mol/(Lmin),则:0.1mol/(Lmin)∶0.1mol/(Lmin)=2∶x,解得x=2,故答案为:2;
(2)速率之比等于化学计量数之比,υ(B)=![]() υ(D)=
υ(D)=![]() ×0.1mol/(Lmin)=0.05mol/(Lmin),故答案为:0.05mol/(Lmin);
×0.1mol/(Lmin)=0.05mol/(Lmin),故答案为:0.05mol/(Lmin);
(3)速率之比等于化学计量数之比,υ(A)=![]() υ(D)=
υ(D)=![]() ×0.1mol/(Lmin)=0.15mol/(Lmin),则反应开始前A的物质的量浓度为0.25molL﹣1+0.15mol/(Lmin)×5min=1molL﹣1,反应开始前放入容器中A的物质的量=1molL﹣1×2L=2mol,故答案为:2mol;
×0.1mol/(Lmin)=0.15mol/(Lmin),则反应开始前A的物质的量浓度为0.25molL﹣1+0.15mol/(Lmin)×5min=1molL﹣1,反应开始前放入容器中A的物质的量=1molL﹣1×2L=2mol,故答案为:2mol;
Ⅲ.(1)一般而言,物质的熔点由高到低的顺序为:原子晶体>离子晶体>分子晶体,Si是原子晶体,熔点最高,CO2和CS2都是分子晶体,相对分子质量越大,熔点越高,所以熔点CS2>CO2;NaCl是离子晶体,熔点比硅低,金属钠的熔点较低,不高于100℃,常温下为固体,因此熔点由高到低的顺序为:Si>NaCl>Na>CS2>CO2,故答案为:Si>NaCl>Na>CS2>CO2;
(2)A固态时能导电,能溶于盐酸,属于金属晶体;B能溶于CS2,不溶于水,属于分子晶体;C固态时不导电,液态时能导电,可溶于水,属于离子晶体;D固态、液态时均不导电,熔点为3 500℃,属于原子晶体,故答案为:金属晶体;分子晶体;离子晶体;原子晶体;
(3)磷和氯反应可生成组成比为1∶3的化合物为PCl3,该化合物中P原子的价层电子对数为3+![]() ×(53×1)=3+1=4,中心原子的杂化轨道类型为sp3杂化,立体构型为三角锥形,故答案为:三角锥形;sp3;4。
×(53×1)=3+1=4,中心原子的杂化轨道类型为sp3杂化,立体构型为三角锥形,故答案为:三角锥形;sp3;4。


科目:高中化学 来源: 题型:
【题目】苯是一种有毒的液体,也是良好的有机溶剂,请回答下列关于苯的问题:

(1)上述反应中属于取代反应的是:__________,属于加成反应的是:__________。
(2)请写出反应③的化学方程式__________。
(3)下列化合物中,能发生类似于反应④的是__________
A.乙烷 B.乙烯 C.乙醇 D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol有机物A(分子式为C6H10O4)经水解得1molB和2molC;C经分子内脱水得D;D可发生加聚反应生成高聚物![]() 。由此可知A的结构简式为( )
。由此可知A的结构简式为( )
A.HOOC(CH2)4COOHB.HOOC(CH2)3COOCH3
C.CH3COO(CH2)2COOCH2CH3D.CH3CH2OOC-COO CH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是( )
2Z(g),此反应达到平衡的标志是( )
A. 容器内密度不随时间变化B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2D. 单位时间消耗0.1mol X同时生成0.2mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶是大规模集成电路、印刷电路版和激光制版技术中的关键材料,某一光刻胶M的合成路线如下: (部分试剂、反应条件和产物已略去)
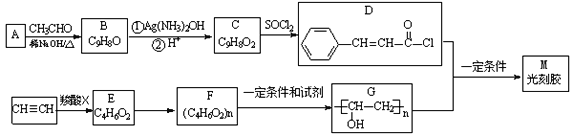
已知:
Ⅰ.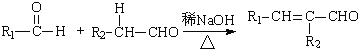 (R1,R2为烃基或氢)
(R1,R2为烃基或氢)
Ⅱ.![]() (R1,R2为烃基)
(R1,R2为烃基)
(1)写出A的结构简式______,B分子中的含氧官能团的名称为_______________。
(2)写出B与银氨溶液发生反应的化学方程式____________________________________。
(3)下列有关光刻胶M的说法正确的是______________________(填字母序号)。
a.可稳定存在于碱性溶液中
b.化学式为C11H10O2
c.可发生氧化反应、还原反应、取代反应
d. 1mol该物质与足量H2发生加成反应时可消耗4mol H2
(4)乙炔和羧酸X发生加成反应生成E,E的核磁共振氢谱有三组峰,且峰面积比为3:2:1, E能使溴水褪色且能发生水解反应,则F的结构简式为________________________。
(5)与C具有相同官能团且含有苯环的同分异构体还有______种(不考虑立体异构);C的另一种同分异构体满足下列条件:①能发生银镜反应和水解反应,其水解产物之一能与FeCl3溶液发生显色反应②苯环上的一氯取代产物只有两种,写出该同分异构体的结构简式:_________。
(6)根据已有知识并结合相关信息,写出以CH3CHO为原料制备CH3CH2CH2COOH的合成路线流程图_______________________(无机试剂任意选用),合成路线流程图示例如下: CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有一学生在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
(1)该学生的操作___(填“正确”或“错误”),其理由是___________;
(2)该操作是否一定有误差?______________________;
(3)若用此方法分别测定c(OH-)相等的氢氧化钠溶液和氨水的pH,误差较大的是____,原因是___;
(4)只从下列试剂中选择实验所需的试剂,你能否区分0.1mol·L-1硫酸溶液和0.01mol·L-1硫酸溶液?____,简述操作过程:____________________________。
试剂:A.紫色石蕊溶液 B.酚酞溶液 C.甲基橙溶液 D.蒸馏水 E.氯化钡溶液 F.pH试纸
Ⅱ.pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图所示。
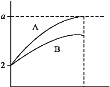
回答下列问题:
(1)若a=5,则A为___酸,B为___酸(填“强”或“弱”),若再稀释100倍,则A的pH___7(填“<”“>”或“=”)。
(2)若A、B都是弱酸,则a的范围是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用脱脂棉包住约0.2gNa2O2粉末,置于石棉网上,往脱脂棉上滴水(如图1),可观察到脱脂棉剧烈燃烧起来。
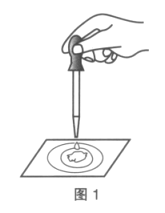
(1)由实验现象所得出的有关Na2O2和H2O反应的结论如下,请补充完整:
a.有___生成;b.反应放热;
Na2O2与水反应的化学方程式是__。
(2)某研究性学习小组拟用图2装置进行实验,以证明上述结论。
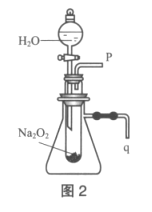
①用以验证结论a的实验方法:打开分液漏斗活塞,__。
②用以验证结论b的实验方法:反应前将q导管口连接一橡胶管浸入盛有水的水槽中,滴入水后,观察到___,证明反应是放热的。
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,向试管中滴入酚酞溶液,发现溶液变红,振荡后,红色褪去。针对褪色现象,查阅资料发现原因之一是反应后溶液中有H2O2,使酚酞氧化漂白。同学们向反应后溶液中加入FeSO4溶液,可观察到__色沉淀生成,该反应的离子方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学方程式为______________________________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1。
(2)向甲、乙两个均为1 L的密闭容器中,分别充入5 mol SO2和3 mol O2,发生反应:2SO2(g)+
O2(g)![]() 2SO3(g) ΔH<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5 mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6 mol。则T1___T2(填“>”、“<”),甲容器中反应的平衡常数K=_____________________。
2SO3(g) ΔH<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5 mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6 mol。则T1___T2(填“>”、“<”),甲容器中反应的平衡常数K=_____________________。
(3)如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3 mol H2通过K1、K3充入A、B中,发生的反应为:N2(g)+3H2(g) ![]() 2NH3(g),起始时A、B的体积相同均为a L。
2NH3(g),起始时A、B的体积相同均为a L。

①下列示意图既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是______。

②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率υ(H2)=___________________________。
(4)将0.1 mol氨气分别通入1 L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为____________(用“c1、c2、c3和>、<、=”表示)。已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol·L-1,求该温度下NH4Cl的水解常数K h 为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述不正确的
元素代号 | A | B | C | D | E | N | G |
原子半径 |
|
|
|
|
|
|
|
主要化合价 |
|
|
|
|
|
|
|
A.稳定性:HG>HN;熔沸点:HG>HN
B.工业上常用电解熔融DN3的方法冶炼D单质
C.B、C原子的最外层子电子数相同
D.![]() 的最高价氧化物的水化物溶液的pH:
的最高价氧化物的水化物溶液的pH:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com