
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是( )
A.11g基态硼原子含有的未成对电子数为3NA
B.1mol基态氟原子能量最高的能级上电子数为7NA
C.100mL1molL-l亚硫酸钠溶液含有的阴离子数目大于0.1NA
D.电解法精炼铜,阴极析出64gCu时,阳极转移的电子数大于2NA
【答案】C
【解析】
A.11g基态硼原子的物质的量n=![]() =
=![]() =1mol,硼的核外电子排布式为1s22s22p1,一个硼原子含有1个未成对电子,1mol基态硼原子含有的未成对电子数为NA,故A错误;
=1mol,硼的核外电子排布式为1s22s22p1,一个硼原子含有1个未成对电子,1mol基态硼原子含有的未成对电子数为NA,故A错误;
B.氟原子的核外电子排布式为1s22s22p5,一个氟原子最高的能级2p上电子数为5个电子,1mol基态氟原子能量最高的能级上电子数为5NA,故B错误;
C.100mL1molL-l亚硫酸钠的物质的量为n=cV=1molL-l×0.1L=0.1mol,SO32-在溶液中存在水解SO32-+H2O![]() H SO3-+OH-, H SO3-+H2O
H SO3-+OH-, H SO3-+H2O![]() H2 SO3+OH-,亚硫酸钠溶液含有的阴离子数目大于0.1NA,故C正确;
H2 SO3+OH-,亚硫酸钠溶液含有的阴离子数目大于0.1NA,故C正确;
D.根据电子守恒,阴极析出的是铜,64gCu的物质的量为1mol,电子转移了2mol,Cu-2e-=Cu2+,所以阳极失去了2 mol电子,失去的电子数为2NA,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
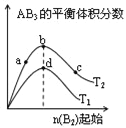
A. 图中T2一定大于T1
B. 图中b点速率一定大于d点速率
C. 达到平衡时,A2的转化率大小为:c>b>a
D. 加入催化剂可以使状态d变为状态b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向VL的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(s)+xD(g) △H>0,容器中A、B、D的物质的量浓度随时间的变化如下图所示。下列说法中不正确的是
C(s)+xD(g) △H>0,容器中A、B、D的物质的量浓度随时间的变化如下图所示。下列说法中不正确的是

A.反应在前10min以B物质表示的平均反应速率v(B)=0.15 mol·L-1·min-1
B.该反应方程式中的x=2
C.若平衡时保持温度不变,压缩容器容积,平衡向逆反应方向移动
D.反应至15min时,改变的条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/L CuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法不正确的是
(已知:Ksp(ZnS)=3×10-25mol2/L2)

A.a、b、c三点中,水的电离程度最大的为b点
B.Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+)
C.该温度下Ksp(CuS)=10-35.4 mol2/L2
D.向100 mL Zn2+、Cu2+浓度均为10-5 mol/L的混合溶液中逐滴加入10-4 mol/L的Na2S溶液,Cu2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。回答下列问题:
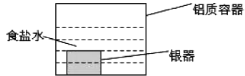
(1)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,该现象属于__________腐蚀(填“化学”或“电化学”)。
(2)铝质容器作为__________极,银器的电极反应式为____________。
(3)处理过程中总反应的化学方程式为_______________。
(4)若将铝质容器中的食盐水用浓硝酸代替,则铝质容器极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置中所用仪器、试剂、现象和结论均正确的是
选项 | 装置 | 现象 | 结论 |
A |
| 装置Ⅲ中有浅黄色沉淀生成 | 苯和浓溴水发生取代反应 |
B |
| 高锰酸钾溶液褪色,溴的四氯化碳溶液褪色 | 石蜡油的分解产物中含有乙烯 |
C |
| 分液漏斗液体流下,锥形瓶中产生大量气体 | 快速制备和收集一定量的氨气 |
D |
| 试管中依次出现白色,黄色沉淀 | 说明 Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别用 0.01mol/L 的 NaOH 溶液滴定与之等浓度的体积均为 25.00mL 的 HA、H3B(三元酸)溶液,溶液的 pH 随V(NaOH)变化曲线如图所示,下列说法错误的是
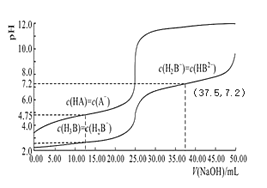
A.常温下 K(HA)数量级约为10-5
B.常温下 0.01mol/L 的 NaH2B溶液的 pH 大于 7
C.NaOH 溶液滴定 HA 溶液应选择酚酞作为指示剂
D.当横坐标为 37.50时,溶液中存在:2c(H+)+c(H2B-)+3c(H3B)=2c(OH-)+3c(B3-)+c(HB2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如下图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )
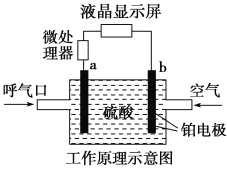
A.电解质溶液中的H+移向a电极
B.b为正极,电极反应式为:O2+4H++4e-=2H2O
C.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
D.呼出气体中酒精含量越高,微处理器中通过的电流越小
查看答案和解析>>
科目:高中化学 来源: 题型:
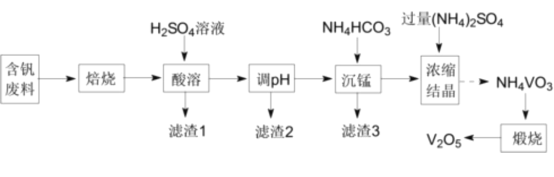
【题目】五氧化二钒(V2O5)为强氧化剂,易被还原成各种低价氧化物,在工业生产中常用作催化剂,即触媒。实验室以含钒废料(含V2O3、CuO、MnO、SiO2、Al2O3、有机物)为原料制备V2O5的一种流程如图:
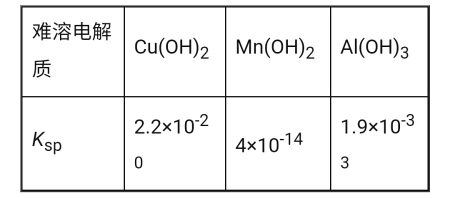
已知I.25℃时,难溶电解质的溶度积常数如表所示:
II.NH4VO3在水中的溶解度:20℃、4.8g·L-1;60℃、24.2g·L-1。
回答下列问题:
(1)“焙烧”的目的是__。
(2)“滤渣1”的用途为__(写出一种即可)。
(3)滤渣2成分为__。通过列式计算说明,常温下,若“调pH”为6,Cu2+是否沉淀完全__。(溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全)
(4)“沉锰”需将温度控制在70°C左右,温度不能过高或过低的原因为___。
(5)滤渣3成分为MnCO3,请写出“沉锰”的离子方程式__。
(6)V2O5最重要的应用是在接触法制硫酸时,作SO2氧化为SO3的催化剂。该催化反应中VO2为中间产物,请用化学方程式表示该催化过程:__、__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com