
【题目】下列事实或操作不符合平衡移动原理的是( )
A. 开启啤酒有泡沫逸出
B. 向FeCl3溶液中加KSCN,有![]() Fe(SCN)3(血红色)+3KCl反应,平衡后向体系中加入KCl固体,使体系红色变浅
Fe(SCN)3(血红色)+3KCl反应,平衡后向体系中加入KCl固体,使体系红色变浅
C. 装有![]() 的烧瓶置于热水中颜色加深
的烧瓶置于热水中颜色加深
D. 实验室用排饱和食盐水的方法收集氯气
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】准确移取![]() 某待测
某待测![]() 溶液于锥形瓶中,用
溶液于锥形瓶中,用![]() 溶液滴定,下列说法正确的是( )
溶液滴定,下列说法正确的是( )
A. 滴定管用蒸馏水洗涤后,直接装入![]() 溶液进行滴定
溶液进行滴定
B. 随着![]() 溶液滴入,锥形瓶中溶液
溶液滴入,锥形瓶中溶液![]() 由小变大
由小变大
C. 用甲基橙作指示剂
D. 滴定达終点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示。下列分析不正确的是
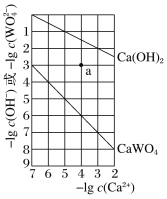
A. 常温时Ksp[Ca(OH)2]>Ksp(CaWO4)
B. a点:无Ca(OH)2沉淀,有CaWO4沉淀
C. 加热饱和Ca(OH)2溶液有白色沉淀生成
D. 常温时这两种饱和溶液中c(Ca2+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_______、_________。(填标号)
A. B.
B.
C. D.
D.![]()
(2)![]() 与
与![]() 具有相同的电子构型,
具有相同的电子构型,![]() 小于
小于![]() ,原因是___________________________。
,原因是___________________________。
(3)![]() 是有机合成中常用的还原剂,
是有机合成中常用的还原剂,![]() 中的阴离子空间构型是____________________。
中的阴离子空间构型是____________________。

(4)如图,Li原子的第一电离能为_________![]() ,O=O键键能为_________
,O=O键键能为_________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:
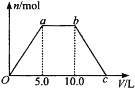
(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
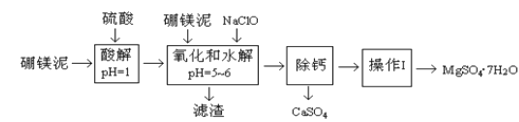
(1)实验中需要1 mol/L的硫酸980 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为____(填写选项字母)。
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有______,____。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法_____。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_______。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O。
(6)实验中提供的硼镁泥共100 g ,得到 MgSO47H2O 为196.8 g ,则MgSO47H2O 的产率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
I. 0.5L 1mol·l-1 氢氧化钠溶液中所含溶质的质量为________g,加水将溶液稀释到10L,其物质的量浓度是_________mol·l-1,取稀释后的溶液 10mL,其溶质的物质的量浓度是________mol·L-1.
Ⅱ.标准状况下,比较等物质的量 H2S、NH3、CH4 三种气体,并完成下列填空。
(1)体积之比________
(2)质量之比为________
(3)原子数之比为________
(4)氢原子数之比为________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com