
 的系统命名2-甲基-3-乙基己烷
的系统命名2-甲基-3-乙基己烷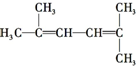
 的键线式:
的键线式:
 中,共平面的碳原子最多有13个,该分子中有4种不同化学环境的H原子.
中,共平面的碳原子最多有13个,该分子中有4种不同化学环境的H原子. 分析 (1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)2,5-二甲基-2,4-己二烯最长碳连有6个碳,主连上有2个双键;
(3)根据键线式省略分子中的碳氢键、碳原子及与碳原子相连的氢原子的特点书写;
(4)连接4个不同原子或原子团的碳原子为手性碳原子;
(5)结合苯以及甲烷的结构判断有机物的空间结构,结合有机物的对称性判断不同化学环境的H原子.
解答 解:(1)最长的碳连有6个碳原子,名称为2-甲基-3-乙基己烷,故答案为:2-甲基-3-乙基己烷;
(2)2,5-二甲基-2,4-己二烯最长碳连有6个碳,主连上有2个双键,结构简式: ,故答案为:
,故答案为: ;
;
(3) 的键线式为
的键线式为 ,故答案为:
,故答案为: ;
;
(4)C4H10O的同分异构体中属于醇类的有多种,其中具有手性碳原子的同分异构体的结构简式为:CH3CH2CH(OH)CH3,
故答案为:CH3CH2CH(OH)CH3;
(5)苯环为平面结构、甲烷中最多3个原子共面,则共平面的碳原子最多有6+1+6=13个;由结构对称可知,苯环上3种H,亚甲基上1种H,共4种H,故答案为:13; 4.
点评 本题考查较为综合,涉及有机物的官能团、命名和键线式等知识的考查,为高频考点,把握官能团及同分异构体及结构对称性分析等为解答的关键,侧重分析与应用能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2与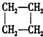 | B. |  与 与 | ||
| C. | 甲苯和二甲苯 | D. | CH2═CH-CH═CH2和CH-CH2-CH2-C≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1=25% | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com