
| A. | X与Y处于同一周期 | B. | 原子序数:a<b | ||
| C. | a-b=m+n | D. | 离子半径:Xn+>Ym- |
分析 由aXn+和bYm-的电子层结构相同知,这两种离子的核外电子数相等,核外电子数=核内质子数-阳离子的电荷数=核内质子数+阴离子的电荷数,所以得:a-n=b+m,即a-b=n+m,可知a在b的下一周期,具有相同电子层结构的离子,核电荷数越大离子半径越小,以此解答该题.
解答 解:由aXn+和bYm-的电子层结构相同知,这两种离子的核外电子数相等,核外电子数=核内质子数-阳离子的电荷数=核内质子数+阴离子的电荷数,所以得:a-n=b+m,即a-b=n+m,
A.a-b=n+m,可知a在b的下一周期,故A错误;
B.a-b=n+m,则原子序数:a>b,故B错误;
C.由分析可知a-b=n+m,故C正确;
D.电子层结构相同的离子,离子半径随着原子序数增大而减小,原子序数X>Y,所以离子半径Ym->Xn+,故D错误;
故选C.
点评 本题考查电子层结构相同离子的比较,侧重考查学生分析判断能力,涉及离子半径比较、元素位置比较,知道阴阳离子核外电子数的计算方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
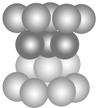
| A. | 此种堆积为面心立方最密堆积 | |
| B. | 该种堆积方式称为铜型 | |
| C. | 该种堆积方式可用符号…ABCABC…表示 | |
| D. | 该种堆积方式所形成晶胞中原子的空间占有率为68% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| NaCl | MgCl2 | CaCl2 | SiCl4 | |
| 熔点(℃) | 801 | 712 | 782 | -68 |
| 沸点(℃) | 1 465 | 1 412 | 1 600 | 57.6 |
| A. | 仅① | B. | 仅② | C. | ①②④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
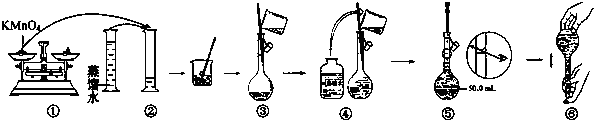
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | NaOH+HCl═NaCl+H2O | ||
| C. | Fe+CuSO4═Cu+FeSO4 | D. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com