
下列说法正确的是( )
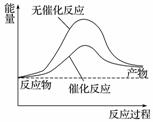
A.右图可表示水分解过程中的能量变化
B.若2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1,则碳的燃烧热为110.5 kJ·mol-1
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应H2(g)+Cl2(g)===2HCl(g)
ΔH=-a kJ·mol-1,
Ⅱ: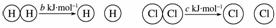
且a、b、c均大于零,则断开1 mol H—Cl键所需的能量为 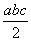 kJ
kJ
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
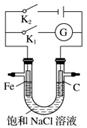
A.K1闭合,铁棒上发生的反应为2H++2e-—→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
试比较下列各组ΔH的大小。
(1)同一反应,生成物状态不同时
A(g)+B(g)===C(g) ΔH1<0
A(g)+B(g)===C(l) ΔH2<0
则ΔH1____ΔH2(填“>”、“<”或“=”,下同)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:P4(g)+6Cl2(g)===4PCl3(g),
ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。
下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能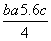 kJ·mol-1
kJ·mol-1
D.P—P键的键能为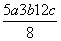 kJ·mol-1
kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,发生反应:①M(s)+N(g)??R(g) ΔH=-Q1 kJ·mol-1,
②2R(g)+N(g)??2T(g) ΔH=-Q2 kJ·mol-1。Q1、Q2、Q3均为正值。下列说法正确的是( )
A.1 mol R(g)的能量总和大于1 mol M(s)与1 mol N (g)的能量总和
B.将2 mol R(g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ
C.当1 mol M(s)完全转化为T(g)时(假定无热量损失),放出热量(Q1+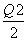 ) kJ
) kJ
D.M(g)+N(g)??R(g) ΔH=-Q3 kJ·mol-1,则Q3<Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)2013年以来,全国很多地区都曾陷入严重的雾霾和污染天气中,冬季取暖排放的CO2、汽车尾气等都是形成雾霾的因素。
已知:①N2(g)+O2(g)===2NO(g)
ΔH=+179.5 kJ·mol-1
②2NO(g)+O2(g)===2NO2(g)
ΔH=-112.3 kJ·mol-1
③2NO(g)+2CO(g)===N2(g)+2CO2(g)
ΔH=-759.8 kJ·mol-1
下图是在101 kPa,298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO过程中能量变化的示意图。则a=________。

(2)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O CO+H2+O2
CO+H2+O2
已知:


①反应Ⅱ是______反应(填“吸热”或“放热”),其原因是
________________________________________________________________________。
②反应A的热化学方程式是____________。
(3)一定条件下,在容积为3 L的密闭容器中反应:CO(g)+2H2(g)??CH3OH(g)达到化学平衡状态。
根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。
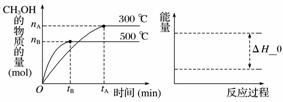
查看答案和解析>>
科目:高中化学 来源: 题型:
用“酸性”、“碱性”、“中性”或“不确定”填空。
(1)pH<7的溶液( )
(2)pH=7的溶液( )
(3)c(H+)=c(OH-)的溶液( )
(4)c(H+)=1×10-7mol·L-1的溶液( )
(5)c(H+)>c(OH-)的溶液( )
(6)0.1 mol·L-1的NH4Cl溶液( )
(7)0.1 mol·L-1的NaHCO3溶液( )
(8)0.1 mol·L-1的NaHSO3溶液( )
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)测定NaOH溶液浓度,可用滴定管、锥形瓶、烧杯、NaOH溶液、0.100 0 mol·L-1盐酸达到目的( )
(2014·安徽理综,9D)
(2)用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低( )
(2014·大纲全国卷,6D)
(3) ( )
( )
(2014·山东理综,10B)
(4)50 ℃时,pH=4的醋酸中,c(H+)=4.0 mol·L-1( )
(2013·广东理综,12A)
(5)50 ℃时,pH=12的纯碱溶液中,c(OH-)=1.0×10-2 mol·L-1( )
(2013·广东理综,12C)
(6)在蒸馏水中滴加浓硫酸,Kw不变( )
(2013·天津理综,5A)
(7)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同( )
(2013·天津理综,5D)
(8)25 ℃与60 ℃时,水的pH相等( )
(2012·福建理综,10B)
(9)中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等( )
(2012·福建理综,10C)
(10)用0.200 0 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和( )
(2012·浙江理综,12C)
(11)常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4( )
(2012·浙江理综,12A)
(12)“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,须经干燥或润洗后方可使用( )
(2011·浙江理综,8C)
查看答案和解析>>
科目:高中化学 来源: 题型:
基态硼原子的电子排布式为
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com