
| A.③④⑤⑦ | B.②④⑥ | C.仅②⑥ | D.②③⑥⑦ |
科目:高中化学 来源:不详 题型:单选题
| A.所有元素中,氢原子质量最轻,在一定条件下可将氢气制成为液体 |
| B.氢在自然界中的存在较为普遍,主要以化合态形式贮存于水中 |
| C.氢气燃烧性能好,点燃快,与空气混合时有广泛的可燃范围 |
| D.氢能利用形式多,目前工业制氢技术、设备简单、效率高、成本低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| | 天然气 | 石脑油 | 重油 | 煤焦 |
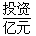 | 5.6 | 6.5 | 8.0 | - |
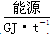 | 28~30 | 35.5 | 41.8 | 54.4 |
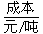 | 257 | 390~447 | 220~280 | 500 |
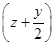 O2=MezOy+zSO2
O2=MezOy+zSO2 CH4(g)+H2O(g);正反应放热,甲烷化的条件是__________________。
CH4(g)+H2O(g);正反应放热,甲烷化的条件是__________________。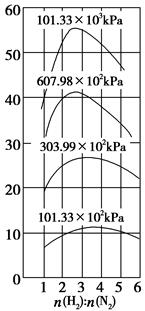
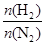 及压强的变化关系。纵坐标可能是____________,结合目前生产的条件,应控制的
及压强的变化关系。纵坐标可能是____________,结合目前生产的条件,应控制的 是________。
是________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2NaOH+Cl2=NaCl+NaClO+H2O |
B.H2+Cl2 2HCl 2HCl |
C.2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 2NaOH+H2↑+Cl2↑ |
| D.2HClO=2HCl+O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硬水的软化 |
| B.电解饱和食盐水制造NaOH |
| C.电渗析法淡化海水 |
| D.海水中提取金属Mg |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 ,其平衡常数表达式为K= 。
,其平衡常数表达式为K= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
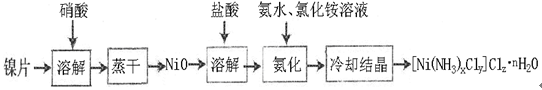
 LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:
LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为: 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.从沸腾炉出来的炉气必须净化,主要目的是防止催化剂中毒 |
| B.之所以叫“接触法”是因SO2被氧化成SO3时反应是在催化剂表面进行的 |
| C.黄铁矿粉碎成细小矿粒,在沸腾炉中燃烧快、反应完全,提高了原料的利用率 |
| D.SO3用稀硫酸吸收而不用水吸收,可防止形成酸雾并使SO3吸收完全 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com