
【题目】A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | A的第一电离能低于同周期左右相邻元素 |
B | B原子中成对电子数等于未成对电子数的2倍 |
C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
(1)写出上述一种元素与氢元素形成的X2Y2型非极性分子的结构式:_______.
(2)写出E元素的元素符号:______,其价电子排布图为:_______.
(3)A与D形成化合物的化学式为 __,是_______分子(填“极性”或“非极性”)
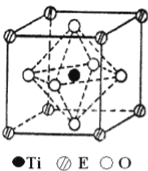
(4)在ETiO3晶胞中(结构如图所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为__个、__个.
(5)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3﹣.N3﹣的空间构型为______,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是_____,E的配位数是_____.
【答案】 H﹣C≡C﹣H Co ![]() BCl3 非极性 6 12 直线形 NH3和N3﹣ 6
BCl3 非极性 6 12 直线形 NH3和N3﹣ 6
【解析】试题分析:A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键,说明C属于非金属元素,如果s轨道含有4个电子,则C是O元素,如果s轨道含有6个电子,则C是Mg元素,镁和非金属元素易形成离子键,所以C是O元素;A的第一电离能低于同周期左右相邻元素,根据元素周期律知,该元素位于第IIIA族或第VIA族,且原子序数小于C,则A是B元素;B原子中成对电子数等于未成对电子数的2倍,且原子序数大于A而小于C,则B是C元素;D与A、B、C均不同周期,其一个单质分子中只有一个σ键,且原子序数大于8则D是Cl元素;E的原子序数比所处周期中未成对电子数最多的元素大3,第四周期中,未成对电子数最多的元素是Cr,其原子序数是24,则E是Co元素。
(1)与氢元素形成的X2Y2型非极性分子的元素是C元素,该分子为乙炔,乙炔的结构式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)E是Co元素,其4s能级上有2个电子,3d能级上有7个电子,3d和4s能级上电子为其价电子,所以其价电子排布图为![]() ,故答案为:Co;
,故答案为:Co;![]() ;
;
(3)A是B元素,D是Cl元素,二者形成的化合物是BCl3,该分子中为平面正三角形结构,正负电荷重心重合,为非极性分子,故答案为:BCl3;非极性;
(4)根据图知,1个Ti原子周围距离最近的O原子数目是6,1个E原子周围距离最近的O原子数目=3×8×![]() =12,故答案为:6;12;
=12,故答案为:6;12;
(5)N3-中中心原子价层电子对个数是2且不含孤电子对,所以其空间构型为直线形,[Co(N3)(NH3)5]SO4中配体是NH3和N3ˉ,E的配位数是6,故答案为:直线形;NH3和N3ˉ;6。


科目:高中化学 来源: 题型:
【题目】下列关于SO2的说法中,不正确的是
A.SO2能使品红溶液褪色,是因为SO2具有漂白性
B.SO2在空气中极易被氧化为SO3
C.SO2通入Na2SO3或NaHCO3溶液中均能发生反应
D.SO2是形成酸雨的大气污染物之一,主要来自于化石燃料的燃烧和工厂排放的废气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列叙述错误的是( )
A. 18gH2O中含有的质子数为10NA
B. 1.0L1.0mo1·L-1的NaAlO2水溶液中含有的氧原子数为2NA
C. 46gNO2和N2O4混合气体中含有原子总数为3NA
D. 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
A.ClO2是氧化产物
B.KClO3在反应中得到电子
C.H2C2O4在反应中被还原
D.1 mol KClO3参加反应有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
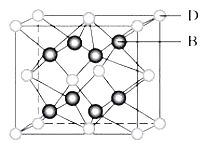
【题目】有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E正一价阳离子M能层电子已排满。D与B可形成离子化合物其晶胞结构如图所示。请回答下列问题:
(1)E元素原子基态时的价电子排布图为___________;
(2)A2F分子中F原子的杂化类型是_______,F的氧化物FO3分子空间构型为______;
(3)CA3极易溶于水,其原因主要是________,试判断CA3溶于水后形成CA3·H2O的合理结构________(填字母代号),从氢键的形成角度回答推理依据是:___________。
(a)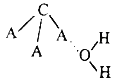 (b)
(b)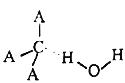
(4)E的晶胞常采取________堆积方式。
(5)从图中可以看出,D跟B形成的离子化合物的化学式为_________;该离子化合物晶体的密度为ag/cm3,则晶胞的体积是_______cm3(写出表达式即可,NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关于Cl2的说法中,错误的是
A. Cl2是一种黄绿色、密度比空气大的有毒气体
B. 红热的铁丝在Cl2中剧烈燃烧,产生白色烟雾
C. 工业上用Cl2和石灰乳为原料制造漂白粉
D. Cl2能与水反应生成盐酸和次氯酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Se、Br两种元素的部分信息如图所示,下列说法正确的是
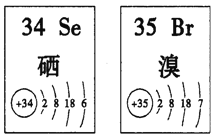
A. 原子半径:Br>Se>P B. 还原性:S2->Se2->Br-
C. SeO2既有氧化性又有还原性 D. 在Se2Br2分子中只含有极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液能与铝作用生成H2,则溶液中一定可以大量共存的离子组是
A. Cl-、Ba2+、Mg2+、ClO- B. Cl-、SO42-、Cu2+、Mg2+
C. Cl-、SO42-、K+、Na+ D. HCO3-、NO3-、Na+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列关于氯气的实验装置能达到实验目的的是

①可用于氯气的收集 ②若气球干瘪,证明Cl2可与NaOH反应 ③可证明氯气具有漂白性 ④可用于实验室中氯气的尾气吸收
A. ①② B. ①③ C. ②③ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com