
����Ŀ��(1)25��ʱ��Ũ�Ⱦ�Ϊ 0.10molL��1 �İ�ˮ�� NH4 Cl ��Һ
��NH4 Cl ��Һ��________�ԣ�ԭ����(�����ӷ���ʽ��ʾ)________�������������İ�ˮ��ʹ��Һ�� c(NH4+)=c(Cl��)������Һ�� pH________7 (��������������������=��).
�ڰ�ˮ�Լ��Ե�ԭ��(�����ӷ���ʽ��ʾ)________����ˮ�м��� NH4Cl ���壬��ˮ�ĵ���̶�________(����������������С������������)����Һ�� pH ��________(����������������С������������)��
(2)������ʵ�У���˵�� NH3��H2O�������________
��0.1 mol��L��1 NH3��H2O ��Һ����ʹ��̪��Һ���
��0.1 mol��L��1 NH4Cl ��Һ������
��0.1 mol��L��1NH3��H2O ��Һ�ĵ��������� 0.1 mol��L��1NaOH ��Һ��
�ܵ������ 0.1 mol��L��1NH3��H O ��Һ�� 0.1 mol��L��1 HCl ��Һǡ����ȫ��Ӧ
A.�٢ڢ� B.�ڢ� C.�ڢ� D.�ۢ�
���𰸡��� NH4++H2O![]() NH3��H2O+H+ 7 NH3��H2O
NH3��H2O+H+ 7 NH3��H2O![]() NH4++ OH- ��С ��С B
NH4++ OH- ��С ��С B
��������
��1����NH4ClΪǿ�������Σ�笠�����ˮ�⣺NH4++H2O![]() NH3��H2O+H+������Һ�����ԣ����������İ�ˮ��ʹ��Һ�� c(NH4+)=c(Cl��)��������Һ�д��ڵ���غ㣺c(NH4+)+c(H+)=c(Cl��)+c(OH-)������Һ�����ԣ�pH=7���ʴ�Ϊ���NH4++H2O
NH3��H2O+H+������Һ�����ԣ����������İ�ˮ��ʹ��Һ�� c(NH4+)=c(Cl��)��������Һ�д��ڵ���غ㣺c(NH4+)+c(H+)=c(Cl��)+c(OH-)������Һ�����ԣ�pH=7���ʴ�Ϊ���NH4++H2O![]() NH3��H2O+H+��7��
NH3��H2O+H+��7��
�ڰ�ˮΪ������ڵ���ƽ�⣬NH3��H2O![]() NH4++ OH-����ˮ�м��� NH4Cl ���壬NH4+���࣬��ˮ�ĵ���ƽ�������ƶ�������̶ȼ�С��c(OH-)��С����Һ�� pH����С���ʴ�Ϊ��NH3��H2O
NH4++ OH-����ˮ�м��� NH4Cl ���壬NH4+���࣬��ˮ�ĵ���ƽ�������ƶ�������̶ȼ�С��c(OH-)��С����Һ�� pH����С���ʴ�Ϊ��NH3��H2O![]() NH4++ OH-����С����С��
NH4++ OH-����������
��2���ټ�������Һ������ʹ��̪��Һ��죬����˵�� NH3��H2O���������
��NH4ClΪǿ�������Σ�笠�����ˮ�⣺NH4++H2O![]() NH3��H2O+H+������Һ�����ԣ���˵�� NH3��H2O�������ȷ
NH3��H2O+H+������Һ�����ԣ���˵�� NH3��H2O�������ȷ
��Ũ����ȣ���Һ�ĵ�������������Ũ�ȳ����ȣ�NH3��H2O ��Һ�ĵ���������NaOH��Һ����˵����ˮ���ֵ��룬Ϊ�������ȷ��
�������ȡ�Ũ����ȣ����ʵ�����ȣ�������ǿ������������ǡ����ȫ��Ӧ������˵�� NH3��H2O����ܴ��� ѡB���ʴ�Ϊ��B��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д����ȷ����
A.��CaCl2 ��Һ��ͨ������CO2���壺Ca2+ + CO2 + H2O=CaCO3�� + 2H+
B.����ʯ����ᷴӦ��CaCO3 + 2CH3COOH= Ca2+ + 2CH3COO��+ H2O + CO2��
C.�Ʊ�Fe(OH)3���壺Fe3+ + 3H2O![]() Fe(OH)3�����壩+ 3H+
Fe(OH)3�����壩+ 3H+
D.����̼��������Һ������ʯ��ˮ��Ӧ��Ca2+ + OH��+ HCO3��=CaCO3�� + H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����÷�ͭм�������������Ʊ�����������ͭ���壩�����̡�
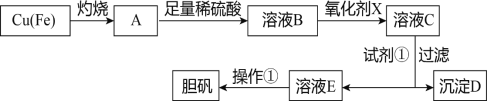
����������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
��ʼ���� | 2.7 | 7.5 | 4.4 |
��ȫ���� | 3.7 | 9.7 | 6.7 |
��ش�
��1����ҺB�к��е���������____________________�������ӷ��ţ���
��2��������������������������X����__________������ĸ����
a��NaClO b��H2O2 c��KMnO4
��3�������Լ�����Ϊ�˵���pH��Ҫ����pH��Χ��_____________�����Լ��ٿ���ѡ��______________���ѧʽ����
��4������D������������ۣ������Ƶ�FeCl2��Һ��ʵ���ұ���FeCl2��Һ���������������ۣ���ԭ����____________________________________�������ӷ���ʽ��ʾ����
��5����ҺE���������ٿɵõ�������������Ϊ________________________�����ˡ�ϴ�ӡ�
��6����֪��Һ��c��Cu2+����pH�Ĺ�ϵΪlgc��Cu2+��=8.6-2pH������Һ��c��Cu2+��Ϊ1mol/L����ʱ��Һ�е�Fe3+�ܷ������ȫ��___________����ܡ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���Ʊ�����������ȡ������װ��(����װ����ʡ��)��Һ©������Һ�巴Ӧ�Լ�A����ƿ��ʢ��Ӧ�Լ�B�����������գ�
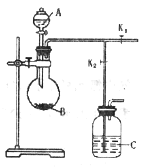
(1)ʵ�����Ʊ�����������Լ���_____________��________________��
(2)��������巢��װ�������Եķ�����____________��
(3)װ��C�����ն�����������װ�ã�����ʢ�ŵ����ռ�Ϊ__________��ʵ���������β������ʱ���Ի�������K1��K2�Ŀ�����_____________________��
(4)����ø���װ���Ʊ����ᣬ��ʱCƿ�����Լ�Ϊ_____________����ʱC��Һ����ܻᷢ��������������ı����е�װ�ã�Ҫ�˷���һ��ȫ������������Cƿ���ټ����л��Լ���ס�����ܹܿڣ����л��Լ�����Ϊ___________�����պ� Cƿ�е�Һ�徭��_____����������ᡣ
(5)��ͬѧ�ø�װ�òⶨһ������С�մ���Ʒ(������NaCl)��̼�����ƵĴ��ȣ�������C�м�������������Һ���ն�����̼��ͨ��Cƿ���صõ�������̼�����������̼�����Ƶĺ�����ʵ����С�մ���ƫ�ͣ�����Ϊʵ����ƫ�͵�ԭ����_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. 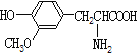 ��
�� ������-�������һ�Ϊͬϵ��
������-�������һ�Ϊͬϵ��
B. CH3CH��CHCH3�����е��ĸ�̼ԭ����ͬһֱ����
C. ��ϵͳ����������������ϵͳ��������������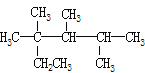 ��������2��3��4-����-2-�һ�����
��������2��3��4-����-2-�һ�����
D. ![]() ��һ������
��һ������![]() ��һ����ﶼ��4�֣������������칹��
��һ����ﶼ��4�֣������������칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
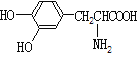
����Ŀ��ҩ�ﱴŵ����������ˮ����Ͷ�������������һ�������·�Ӧ�Ƶá�����������ȷ���ǣ� ��
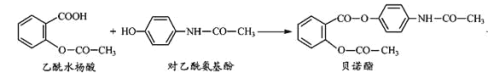 +H2O
+H2O
A.��ŵ�������������ֺ���������
B.��ŵ�������� NaOH ��Һ���ȣ�������������ˮ�����ƺͶ�������������
C.����ˮ����Ͷ����������Ӿ����� NaHCO3��Һ��Ӧ
D.���� FeCl3 ��Һ��������ˮ����Ͷ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���ﺬ�� NO ������������ȼ��ȼ�յĸ�����������������Ӧ���£�N2(g)��O2(g)2NO(g) ��H>0����֪�÷�Ӧ�� 240��ʱ��ƽ�ⳣ�� K��64��10��4����ش�
(1)���¶��£��� 2 L ���ܱ������г��� N2 �� O2 �� 1 mol��5���Ӻ�O2�����ʵ���Ϊ 0.5 mol���� ��N2��ʾ�ķ�Ӧ����Ϊ________��
(2)�ٶ��÷�Ӧ���ں��������½��У��жϸ÷�Ӧ�ﵽƽ��ı�־________ (����ĸ���)��
A.���� 1 mol N2 ͬʱ���� 1 mol O2 B.��������ܶȲ���
C.�������ƽ����Է����������� D.2v(N2)����v(NO)��
(3)�� N2��O2 �Ļ�����������º����ܱ������У����б仯������ȷ����________ (����ĸ���)��
A. 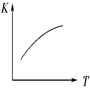 B.
B. 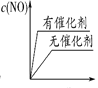 C.
C. 
(4)���¶��£�ijʱ�̲�������� N2 ��O2��NO ��Ũ�ȷֱ�Ϊ 2.5��10��1 mol��L��1��4.0��10��2 mol��L��1�� 3.0��10-3mol��L-1����ʱ��Ӧ________ (�������ڻ�ѧƽ��״̬����������Ӧ����������������淴Ӧ���������)��������________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ľṹ��ͼ��ʾ��
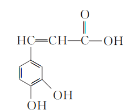
��1������������__(���������������������������)��
��2���������к������������ǻ���__(������)��
��3��������Һ�еμ�NaHCO3��Һ��ʵ������Ϊ__��
��4����������Һ��ʹ���Ը��������Һ��ɫ��˵�����������__�ԡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪PH3��NH3�ṹ���ƣ��ش��������⣺
��PH3�ĵ���ʽ________���ṹʽ________��
�ڼ��ι���Ϊ________��
������ԭ�Ӳ�ȡ________�ӻ���
��PH3�����еĻ�ѧ��________�����������������������ԣ������Ϊ________�����������������Ǽ����������ӡ�
��PH3��NH3�����ȶ��ԣ�________��ǿ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com