
| A�� | ȡһ�������壬�ܽ⣬����Һ��ͨ��������CO2���۲쵽�о���������˵��ԭ������һ������ Na2CO3 | |
| B�� | ȡһ�������壬�ܽ⣬����Һ�м�������CaO��ĩ����ַ�Ӧ��۲쵽�а�ɫ�������ɣ�˵�� ԭ������һ������Na2CO3 | |
| C�� | ȡһ�������壬�ܽ⣬����Һ�еμ�����AgNO3��Һ���а�ɫ�������ɣ����������˵��ԭ������һ������NaCl | |
| D�� | ��ȡ3.80g���壬���������أ����������� 0.620g������ͯϡ�����ܽ�������壬��ַ�Ӧ���ռ���0.880g���壬˵��ԭ�����н�����Na2CO3��NaHCO3 |
���� A������Һ��ͨ��������CO2���۲쵽�о���������һ������Na2CO3+CO2+H2O=2NaHCO3��
B����CaO������Na2CO3��NaHCO3��Ӧ���ɰ�ɫ������
C��Na2CO3��NaCl����AgNO3��Һ��Ӧ���ɰ�ɫ������
D��������������أ��������ᣬ˵����̼�����ƹ��壬̼���������ȷֽ�Ϊ̼���ơ�ˮ�Լ�������̼������̼Ԫ���غ���Լ���������������
��� �⣺A������Һ��ͨ��������CO2���۲쵽�о���������һ������Na2CO3+CO2+H2O=2NaHCO3�����о���������˵��ԭ������һ������Na2CO3����A��ȷ��
B����CaO������Na2CO3��NaHCO3��Ӧ���ɰ�ɫ���������а�ɫ�������ɣ�����˵��ԭ������һ������Na2CO3����B����
C��Na2CO3��NaCl����AgNO3��Һ��Ӧ���ɰ�ɫ���������а�ɫ�������ɣ�����˵��ԭ������һ������NaCl����C��ȷ��
D����ȡ3.80g���壬���������أ�����������0.620g����
2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+CO2��+H2O��m
168 106 1 62
n 0.62g
��Ϲ��������֪n��CO2��=$\frac{0.62g}{62g/mol}$=0.01mol����ԭ������к�̼������Ϊ0.02mol��������̼����Ϊ0.01mol��������ϡ�����ܽ�������壬��ַ�Ӧ���ռ���0.880g���壬n��CO2��=$\frac{0.88g}{44g/mol}$=0.02mol����ԭ������к�̼����Ϊ0.01mol����������Ϊ106g/mol��0.01mol+84g/mol��0.02mol=27.4g����ԭ�����к���Na2CO3��NaHCO3��NaCl����D����
��ѡBD��
���� ���⿼�黯ѧʵ�鷽�������ۣ�Ϊ��Ƶ���㣬�������ʵ����ʡ������ķ�Ӧ�����������㡢ԭ���غ��Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬ע��Ԫ�ػ�����֪ʶ��ʵ��Ľ�ϼ�ʵ�������Է�������Ŀ�ѶȲ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �٢ܢ� | C�� | �ڢۢ� | D�� | �ۢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| װ�� | 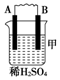 |  |  |
| ���� | ���۽���A�����ܽ� | C���������� | A����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
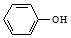 ��
�� �������ʵ��Լ���a������ĸ����
�������ʵ��Լ���a������ĸ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����¶��ܼӿ췴Ӧ�ڵĻ�ѧ��Ӧ���ʣ����CH3OCH3���� | |
| B�� | ��Ӧ��ʹ�ô�������H3���� | |
| C�� | ��Ӧ 3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g���ġ�H=-246��lkJ•mol-1 | |
| D�� | ��Ӧ�۶Է�Ӧ����Ӱ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʳ��ˮ�������� | B�� | �Ӻ�������ȡ�� | ||
| C�� | ������ѹ��Һ�� | D�� | �������ʯ��ʯ��ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaHSeO4��Һ��Na2SeO4��Һ���Լ��� | |
| B�� | pH=3��H2SeO4��NaHSeO4��Һ������ˮ�ĵ���̶ȴ� | |
| C�� | H2SeO4��Һ�еμ�������ˮ�����ӷ���ʽ��H++NH3•H2O=NH4++H2O | |
| D�� | Na2CO3��Һ�м�������H2SeO4�����ӷ���ʽΪ��CO32-+H+=HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 A��HΪ��ѧ��ѧ�г������ʣ�����֮���ת����ϵ��ͼ��ʾ�����г�����AΪ��̬�ǽ������ʣ�CΪ��ɫ�д̼�����ζ�����壬D��GΪ��ɫ����ζ�����壬��C��D����ʹ����ʯ��ˮ����ǣ�E������Ϊ��ɫ����ζ��Һ�壻FΪ����ɫ��ĩ��
A��HΪ��ѧ��ѧ�г������ʣ�����֮���ת����ϵ��ͼ��ʾ�����г�����AΪ��̬�ǽ������ʣ�CΪ��ɫ�д̼�����ζ�����壬D��GΪ��ɫ����ζ�����壬��C��D����ʹ����ʯ��ˮ����ǣ�E������Ϊ��ɫ����ζ��Һ�壻FΪ����ɫ��ĩ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com