
����Ŀ��ijͬѧ��ѧϰԪ�ػ�����֪ʶ�Ĺ����У������о�����A����ͨ�����µĽǶ�չ��������A��B��C��D��E�о�����Ԫ�ء�
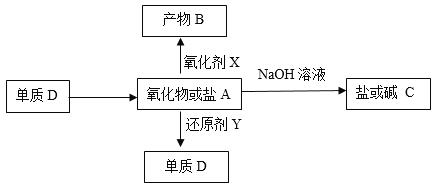
��ش�
��1������Ԫ��Ϊ������Ԫ�أ�����DΪ��ɫ���壬A�������
�� ��Ԫ����Ԫ�����ڱ��е�λ����______��
�� ������A������NaOH��Һ��Ӧ�����ӷ���ʽ��______��
��2����DΪ������AΪ�Σ�����B��KSCN��Һ�ʺ�ɫ��
������˵����ȷ����______������ĸ����
a������D�������������ᡢ�����������ᷴӦ������A
b����A��NaOH��Һ��Ӧʱ�������ڿ����в��ȶ����ױ�O2����
c����ԭ��Y��ѡ��ͭ
����������XΪ���Ը��������Һ��5.6 g ����Dȫ��ת��Ϊ����Bʱ��ת�Ƶ��ӵ����ʵ���Ϊ______mol��
���𰸡� �������ڵڢ�A�� SO2�� OH�� ![]() HSO3�� b 0.3
HSO3�� b 0.3
������������A��B��C��D��E�о�����Ԫ�أ�������ʵ����ʺ�ת����ϵͼ���
��1������Ԫ��Ϊ������Ԫ�أ�����DΪ��ɫ���壬���D��S��A�������A�Ƕ���������
����Ԫ�ص�ԭ��������16����Ԫ�����ڱ��е�λ���ǵ������ڵڢ�A�塣
�ڶ�������������NaOH��Һ��Ӧ�������������ƣ���Ӧ�����ӷ���ʽ��SO2��OH����HSO3����
��2����DΪ������AΪ�Σ�����B��KSCN��Һ�ʺ�ɫ��B�к��������ӣ�����D������A�������Σ�B�����Ρ���
��a�������������ᷴӦ�������������ò�������������a����b����������NaOH��Һ��Ӧʱ�����ɵ������������ڿ����в��ȶ����ױ�O2������������������b��ȷ��c����������ǿ��ͭ��ͭ�����û���������ԭ��Y����ѡ��ͭ��c����ѡb��
����������XΪ���Ը��������Һ��5.6 g �����������ʵ�����0.1mol��ȫ��ת��Ϊ����Bʱ����Ԫ�ػ��ϼ۴�0�����ߵ�+3�ۣ�ת�Ƶ��ӵ����ʵ���Ϊ0.3mol��


 100�ִ�����ĩ���ϵ�д�
100�ִ�����ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NOx������������»�����⻯ѧ�������Ӷ�������صĴ�����Ⱦ���������糧�����к��д���������������ȼ�պ���������д�������ԭ������(��֪��ȼ��ϵͳ�ŷ������е�NOx��90%������NO)��
![]()
��ش�
��1��NO2�������ɫΪ______��
��2���������ʿ����Լ�A����______(����ĸ)��
a��O3 b��CO c��NH3 d��ClO2
��3���Լ�B��ʹ��Na2SO3��Һ���÷�Ӧ�Ļ�ѧ����ʽΪ______��
��4��NO2��������NaOH��Һ����(ԭ����2NO2+2NaOH===NaNO2+NaNO3+H2O)��ȡһ���� NO2�ù�����V1 mL c1 mol��L1NaOH��Һ������ȫ��ʣ��NaOH��V2 mL c2 mol��L1 H2SO4��Һǡ���кͣ������յ�NO2���ʵ�����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����п���Ϊ�������������
A.Ũ����B.��ʯ��C.��ˮ�Ȼ���D.����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƣ�Na2S2O3���ǻ������ż���к����峣�õ�һ��ҩƷ����������ˮ�������ֽ⡣ijʵ����ģ�ҵ���ȡ��������ƣ��䷴Ӧװ�ü������Լ���ͼ��
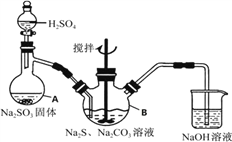
ʵ������������Ϊ��
�ٴ�Һ©��ʹ�����������£��ʵ����ڷ�Һ©���ĵ��٣�ʹ��Ӧ������SO2����Ͼ��ȵ�ͨ��Na2S��Na2CO3�Ļ����Һ�У�ͬʱ�����綯������������ˮԡ���ȣ��С�
��ֱ�������Ļ��Dz�����ʧ����������Һ��pH�ӽ�7ʱ��ֹͣͨ��SO2���塣
��1�������A������____��
��2��д��A�з�����Ӧ�Ļ�ѧ����ʽ____��
��3��Ϊ�˱�֤��������ƵIJ�����ʵ����ͨ���SO2���ܹ�����ԭ����____��
��4��Na2S2O3���������ȼ�������Һ���ױ�Cl2������SO42���ӣ��÷�Ӧ�����ӷ���ʽΪ____��
��5�� Ϊ����֤������������ƹ�ҵ��Ʒ�к���̼���ƣ�ѡ����ͼװ�ý���ʵ�顣
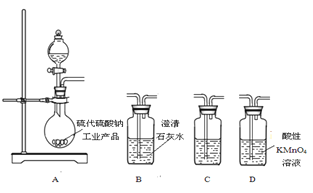
��ʵ��װ�õ�����˳��������____����װ�õ���ĸ���ţ���װ��C�е��Լ�Ϊ____��
����֤�������к���̼���Ƶ�ʵ��������____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ά����C��������ȷ���ǣ�������
A.ά����C��ʹ��ˮ��ɫ
B.ά����C����ʳƷ���Ӽ�
C.ά����C�ֳƿ���Ѫ��
D.ά����C���ܷ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�����ںϳ�ɱ�������߳��ũҩ������ʽΪC3H5Br2Cl����Ӧ�ù㷺��DAP��֬�� 
��֪���봼�ɷ���������������Ӧ��
RCOOR��+R��OH ![]() RCOOR��+R��OH ��R��R�䡢R�����������
RCOOR��+R��OH ��R��R�䡢R�����������
��1��ũҩ����C3H5Br2Cl��ÿ��̼ԭ���Ͼ�����±ԭ�ӣ� ��A�Ľṹ��ʽ�� �� A���еĹ�������������
���ɱ�ϩ����A�ķ�Ӧ������ ��
��2��Aˮ��ɵõ�D����ˮ�ⷴӦ�Ļ�ѧ����ʽ�� ��
��3��C�����ܶ�����ͬ״̬�¼����ܶȵ�6.25����C�и�Ԫ�ص����������ֱ�Ϊ��̼60%����8%����32%��C�Ľṹ��ʽ�� ��
��4������˵����ȷ���ǣ�ѡ�������ĸ�� �� a��C�ܷ����ۺϷ�Ӧ����ԭ��Ӧ��������Ӧ
b��C����2������������ͬ���칹����4��
c��D������IJ�����B������ͬ����Է�������
d��E���з�����ζ���������Ҵ�
��5��E��ˮ����ᆳ�������յõ��״���B�����߾���ѭ��������DAP��֬���Ʊ������н��״���H����IJ��������� ��
��6��F�ķ���ʽΪC10H10O4 �� DAP����Ϊ���Ķ�Ԫȡ���������ȡ���������ڶ�λ���õ��屽���ϵ�һ��ȡ����ֻ�����֣�D��F��Ӧ����DAP����Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӫ�����������彡���ı�֤�� �������ࡢ��֬�������ʡ�ά����������Ӫ�����У�����Ϊ�˵�������ṩ�������� �� ��������������ˮ������ղ����ǰ����ᣬ������Ľṹ�ɱ�ʾΪR��CH��NH2����X����X������Ϊ ��
��ij��ʳƷ���װ�ϵ����ϱ�ǩ��ͼ��ʾ�����������з������ã�̼�����������ֽ⣬�������������ʹʳƷ���ɣ�̼���������ȷֽ�Ļ�ѧ����ʽΪ �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����÷�Ӧ![]() ���Ʊ�CuSO4��Һ���ҷ�Ӧ�������Ⱦ�������÷�Ӧ���Ϊԭ��أ��������缫��ӦʽΪ_____________________��
���Ʊ�CuSO4��Һ���ҷ�Ӧ�������Ⱦ�������÷�Ӧ���Ϊԭ��أ��������缫��ӦʽΪ_____________________��
��2����ҵ���ɻ�ͭ����Ҫ�ɷ�CuFeS2��ұ��ͭ�Ĺ����л�����������������������������ϡH2SO4����������ȡ����������Һ���μ�KSCN��Һ��ʺ�ɫ��˵����Һ�д���Fe3+��������Һ���Ƿ����Fe2+����õķ�����_________________________���û�ѧ��Ӧ����ʽ�����ӷ���ʽ˵������
��3����CuSO4��ҺΪ�������Һ���д�ͭ����Al��Zn��Ag��Pt��Au�����ʣ��ĵ�⾫��������˵����ȷ����_______________��
a.����ȫ��ת��Ϊ��ѧ�� b.��ͭ�ӵ�Դ����������������Ӧ
c.��Һ��Cu2+�������ƶ� d.����������ɻ���Ag��Pt��Au�Ƚ���
��4���ö��Ե缫���CuSO4��Һ����ֻ�������������壬��������Һ��pH_______������С�����䣬��������Һ����仯����Ҫʹ�������Һ�ָ������ǰ��״̬���ɼ���____________�����������������������ɣ�Ҫʹ����ʻָ������ǰ��״̬���ɼ���__________�������������1mol���ָ������ǰ״̬������ʱ��·��ת�Ƶ��ӵ����ʵ���Ϊ__________Ħ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�á���ͼ��ʾ����ʯī�������缫��ⱥ��ʳ��ˮ��װ�ã�����գ�
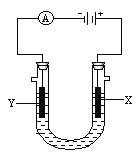
��1��X�ĵ缫������__________���������ĵ缫��ӦΪ____________________________��
��2��Y���ĵ缫������_________������X������ķ�����_________________________��
��3��ijͬѧ��ʵ��ʱ�����ֵ缫���Ͻӷ�������X����δ�ռ���Ԥ�ڲ��һ��ʱ����ֽ����������ӷ�ʽ��������������X�����������˰�ɫ�������˳�����__________���ѧʽ�������γ�ԭ����_______________________________________���ó����ڿ����з��ã�������_____________________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com