
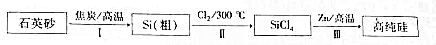
分析 (2)过程Ⅱ中的氯气若来自于以惰性材料为电极电解熔融盐MCl,电解过程中阴极上M+离子得电子生成M;
(3)SiCl4易挥发,遇水产生白雾,说明SiCl4与水反应生成硅酸与氯化氢,所以工业上用浓NaOH溶液吸收尾气中SiCl4,可以生成氯化钠、硅酸钠,根据元素守恒书写化学方程式;将90℃的潮湿氯气冷却至12℃,可以使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量;
(4)A.三个反应均为放热反应,升高温度,平衡逆向移动,平衡常数会减小;
B.为了获得无水、无氧环境,都可以用氮气作保护气;
C.氢气、镁都具有还原性,可以用氢气、镁等还原剂替代锌还原四氯化硅;
D.方案2、方案3中的反应为气体体积增大的反应,增大压强,平衡逆向移动,四氯化硅的转化率下降;
解答 解:(2)过程Ⅱ中的氯气若来自于以惰性材料为电极电解熔融盐MCl,电解过程中阴极上M+离子得电子生成M,阴极的电极反应式为M++e-=M,
故答案为:M++e-=M;
(3)SiCl4易挥发,遇水产生白雾,说明SiCl4与水反应生成硅酸与氯化氢,所以工业上用浓NaOH溶液吸收尾气中SiCl4,可以生成氯化钠、硅酸钠,化学方程式为SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O,将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中,可使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量,故选①②,
故答案为:SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O;①②;
(4)A.三个反应均为放热反应,升高温度,平衡逆向移动,平衡常数会减小,故A错误;
B.为了获得无水、无氧环境,都可以用氮气作保护气,故B正确;
C.氢气、镁都具有还原性,可以用氢气、镁等还原剂替代锌还原四氯化硅,故C正确;
D.方案2、方案3中的反应为气体体积增大的反应,增大压强,平衡逆向移动,四氯化硅的转化率下降,故D错误;
故选BC.
点评 本题考查了硅的制备方案设计、硅及其化合物的性质及化学平衡相关知识等,掌握平衡移动原理的运用,掌握硅及其化合物的性质是解答的关键,难度中等,侧重于考查学生的实验能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. |  检验溶液中是否含有K+ | B. |  除去水中的乙醇 | ||
| C. |  分离乙酸和乙酸钠 | D. |  用MnO2和浓盐酸制备Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlO2-、Na+、HCO3-、K+ | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | K+、Al3+、Cl-、CO32- | D. | Cu2+、NH4+、I-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 为了测量NaHCO3和Na2CO3混合物中Na2CO3的质量分数,有人设计了如下的装置.准确称取混合物样品m g盛于试管B中并连接装置,其中C、D为玻璃管,C带有刻度,回答下面有关小题.
为了测量NaHCO3和Na2CO3混合物中Na2CO3的质量分数,有人设计了如下的装置.准确称取混合物样品m g盛于试管B中并连接装置,其中C、D为玻璃管,C带有刻度,回答下面有关小题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题


| 滴定次数 实验数据ml | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(初读数) | 0.00 | 0.50 | 0.70 | 1.00 |
| V(NaOH)终读数) | 22.60 | 22.55 | 22.65 | 23.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| B. | 50ml18.4mol•L-1浓H2SO4与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol•L-1 | |
| D. | 标况状态下,22.4L氨水含有NA个NH3分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com