
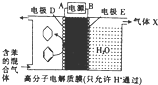
 一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )
一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )| A. | A为电源的正极 | |
| B. | 气体X为H2 | |
| C. | 电极E为阴极 | |
| D. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 |
分析 该装置有外接电源,所以是电解池,电极D上苯得电子和氢离子反应生成环己烷,则D电极是阴极,电极反应式为C6H6+6H++6e-=C6H12,E是阳极,阳极上水失电子生成氧气和氢离子,电极反应式为2H2O-4e-=O2↑+4H+,所以气体X为O2,据此分析解答.
解答 解:该装置有外接电源,所以是电解池,电极D上苯得电子和氢离子反应生成环己烷,则D电极是阴极,电极反应式为C6H6+6H++6e-=C6H12,E是阳极,阳极上水失电子生成氧气和氢离子,电极反应式为2H2O-4e-=O2↑+4H+,所以气体X为O2,
A.该装置是电解池,D是阴极,连接阴极的电极是负极,所以A是负极,故A错误;
B.通入以上分析知,X为O2,故B错误;
C.通入以上分析知,E是阳极,故C错误;
D.D电极是阴极,阴极上得电子发生还原反应,电极反应式为C6H6+6H++6e-=C6H12,故D正确;
故选D.
点评 本题考查电解原理,为高考高频点,会根据有机物结构变化确定得失电子,从而确定阴阳极,会正确书写电极反应式,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-14mol/L的无色溶液:K+、S2-、MnO4-、SO42- | |
| B. | 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 能使甲基橙变红的溶液中:Na+、NH4+、Fe2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O2与18O2互为同位素,它们的性质基本相同 | |
| B. | 多糖、油脂、蛋白质在一定条件都能发生水解反应 | |
| C. | 玻璃、陶瓷、水泥都是硅酸盐产品,属于无机非金属材料 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物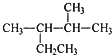 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 | |
| B. | 甲醇、乙醇、甘油互为同系物 | |
| C. | 等物质的量的乙炔、乙醛、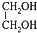 完全燃烧时的耗氧量不相等 完全燃烧时的耗氧量不相等 | |
| D. | 以乙烯为原料制备乙酸乙酯的合成路线可以为: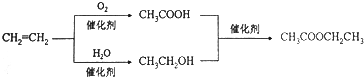 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 惰性电极电解氯化钾溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 能溶解Fe(OH)3的溶液中含有:HCO3-、Na+、Mg2+、Cl- | |
| C. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| D. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力开发新能源和可再生能源 | |
| B. | 城市大力发展轨道交通,少开私家车 | |
| C. | 清洁燃煤、提高燃油质量 | |
| D. | 学校、家庭安装空气净化装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol苯分子中含有双键数为0.3NA | |
| B. | 1L1mol•L-1碳酸钠溶液中阴离子的数目大于NA | |
| C. | 标准状况下,22.4L乙烷中共含有分子数为NA | |
| D. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,转移的电子的数目为0.92NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com