
【题目】对一定量气体体积的探究。
已知1 mol不同气体在不同条件下的体积:
化学式 | 条件 | 1 mol气体体积/L |
H2 | 0 ℃,101 kPa | 22.4 |
O2 | 0 ℃,101 kPa | 22.4 |
CO | 0 ℃,101 kPa | 22.4 |
H2 | 0 ℃,202 kPa | 11.2 |
CO2 | 0 ℃,202 kPa | 11.2 |
N2 | 273 ℃,202 kPa | 22.4 |
NH3 | 273 ℃,202 kPa | 22.4 |
(1)从上表分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积________(填“一定”“一定不”或“不一定”)相等。
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:
①________________________________________________________________________,
②________________________________________________________________________。
(3)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)___________________________________________________________________________
【答案】22.4 L不一定气体分子数目相等相同条件下,气体分子间的平均距离几乎相等V(O2)=n×22.4 L·mol-1=![]() ×22.4 L·mol-1=
×22.4 L·mol-1=![]() ×22.4 L·mol-1=2.8 L。
×22.4 L·mol-1=2.8 L。
【解析】
(1)根据标准状况下气体的摩尔体积进性分析;(2)根据pV=nRT,四同定律(p、V、n、T,三个相同时,第四个一定相同)进行分析;(3)根据标准状况下气体的摩尔体积的计算方法进行解答。
(1)从上表分析得出的结论:①1 mol任何气体,在标准状况下的体积都约为22.4L;②1 mol不同的气体,在不同的条件下,体积不一定相等;(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:①分子数目相等,②分子间的距离几乎相等;(3)在标准状况下,4g O2的体积为:![]() ×22.4L/mol=2.8L。
×22.4L/mol=2.8L。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】丙烯酸可与水反应生成乳酸,化学方程式如下,下列说法正确的是

A. 该反应为加成反应,没有副产物生成
B. 可用Br2/CCl4溶液鉴别丙烯酸和乳酸
C. 丙烯酸与乳酸都属于有机酸,两者不发生反应
D. 1mol乳酸分别与足量Na、NaOH、NaHCO3反应,消耗三者物质的量之比为2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关塑料的说法不正确的是( )
A.塑料的主要成分是合成树脂
B.热塑性塑料可以反复加工、多次使用
C.酚醛树脂可制热固性塑料
D.粉碎后填埋于土壤中是处理塑料废弃物的最佳方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol) ( )
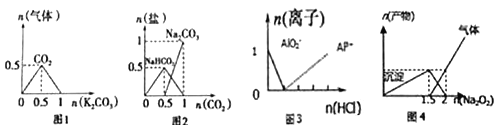
A. 图1: n (HCl)=1mol,K2CO3加入到HCl溶液中,在敝口容器中生成的气体
B. 图2 : n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐
C. 图3 :n(NaAlO2)=1mol,HCl加入到NaAlO2溶液中离子的存在情况
D. 图4 : n(AlCl3)=1mol, Na2O2加入AlCl3溶液反应的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的燃烧热相等的是
A. 碳和二氧化碳B. 1mol碳和3mol碳
C. 3mol乙炔(C2H2)和1mol苯(C6H6)D. 天然气和酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为XY2(l)+3O2(g)﹦XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 g·L-1。
(1)反应前O2的体积是________mL(标准状况下)。
(2)化合物XY2的摩尔质量是________。
(3)若XY2分子中X、Y两元素质量比是3:16,则X、Y两元素分别是________和________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算
(1)24.5 g硫酸的物质的量是________mol,1.5 mol碳酸钠的质量是______ g。
(2)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为10.8 g。则混合气体中CO的物质的量是________mol。
(3)用36.5%的浓盐酸(密度为1.25 g·cm-3)在容量瓶中配制480 mL1mol·L-1的稀盐酸。经计算需要__________mL浓盐酸。
(4) 将15.6 g过氧化钠与足量二氧化碳反应时,反应中转移_________mol电子。
(5)将钠、镁、铝各0.3mo1分别放入100mL1mol·L-1的盐酸中,同温同压下产生的气体体积比是____________。
(6)将20.8gCu、Fe合金与足量的稀硝酸反应后,收集到标准状况下NO气体6.72L,向反应后溶液中加入足量的NaOH溶液,生成的沉淀的质量是_________g。原来合金中含Cu______mol,Fe______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常下图装置进行铜跟浓硫酸反应等一系列实验。请回答下列问题
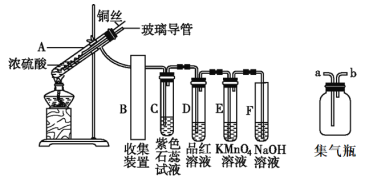
(1)装置B就是右上图的集气瓶,则装置A的导管应连接集气瓶的____(填“a”或“b”)进口;
(2)用装置A制备SO2的优点主要是_________________________。(任答一条即可);
(3)装置A中的反应方程式为______________________________________________;
(4)装置C中的现象是________________;反应结束后加热D中溶液,现象是___________;
(5)装置E中出现的现象可以说明SO2具有__________性;
(6)装置F中的反应的离子方程式为____________________________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com