
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A. 温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小
B. 三个不同温度中,313 K时Ksp(SrSO4)最大
C. 283 K时,图中a点对应的溶液是饱和溶液
D. 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
科目:高中化学 来源: 题型:
【题目】某苯的同系物分子式为C8H10,若苯环上的氢原子被卤原子取代,生成的一卤代物有三种同分异构体,则该苯的同系物可能有( )
A. 4种 B. 3种 C. 2种 D. 1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017陕西黄陵】 磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式 。
②直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x= (用n表示)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
□H2PO2-+□Ag+ + □ = □PO43-+ □Ag +□
(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下
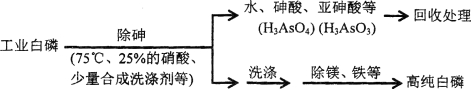
①除砷过程在75℃下进行,其合理的原因是_______(填字母)。
a.温度不宜过高,防止硝酸分解 b.适当提高温度,加快化学反应速率
c.使白磷熔化,并溶于水 d.降低白磷的毒性
②硝酸氧化除砷时被还原为NO,若氧化产物为等物质的量的亚砷酸与砷酸,则化学反应方程式为____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要的漂白剂。某小组开展如下实验,按如图装置制取无水NaClO2晶体,回答下列问题:
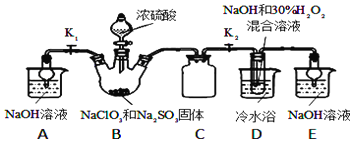
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
(1)装置C的作用是_________________;
(2)已知装置B中的产物有ClO2气体,则B中反应的方程式为_________________;装置D中反应生成NaClO2的化学方程式为_________________________;
(3)从装置D反应后的溶液中获得无水NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②____________;③用38℃~60℃热水________;④在_____________条件下干燥得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_________和____________;
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+4I-+4H+═2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32-═2I-+S4O62-).请计算所称取的样品中NaClO2的物质的量为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关工业生产的叙述不正确的是( )
A. 用海水淡化后的浓缩海水作原料提取溴
B. 在太阳能资源相对充足的沿海地区建造海水淡化厂
C. 利用“海水→氯化钠→金属钠→氢氧化钠”的工艺流程生产烧碱
D. 利用“海水→氢氧化镁→氯化镁→金属镁”的工艺流程生产金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都具有10个电子,其结构特点如下:
粒子代码 | a | b | c | d | e | f | g |
原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;c和f在一定条件下形成一个g分子和一个d分子,试写出:
(1)a粒子的原子结构示意图___________
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为___>_____ (用化学式表示)。
(3)d与一种含有极性键双核18电子分子反应的化学方程式为 ______。
(4)g与一种含有非极性键双核18电子分子反应的化学方程式为__________
上述反应中,断裂化学键是__________,写出的化学键是________(填“离子键”、“极性键”、“非极性键”、“氢键”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验探究:探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各小题
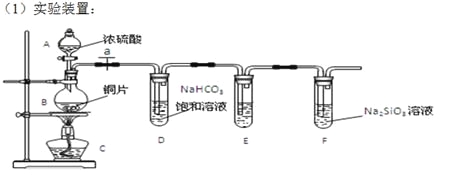
填写所示仪器名称A B 。
(2)实验步骤:连接仪器、___________、加药品后,打开a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是 ;装置E中足量酸性KMnO4溶液的作用是 ;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是 ;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性 (填“能”或“否”,1分),改进方法是: 。试管F中发生反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com