
| A、金属氧化物都能与水反应生成碱 |
| B、非金属氧化物都能与水反应生成酸 |
| C、氧化铝既能与酸反应又能与氨水反应 |
| D、氧化铝坩埚不能用于熔融烧碱 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- | ||||
B、用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-
| ||||
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- | ||||
| D、稀硫酸滴在铜片上:Cu+2H+→Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学键断裂时要吸收能量,形成新化学键时要放出能量 |
| B、化学变化的实质是旧化学键断裂,新化学键形成 |
| C、在化学变化过程中,一定要吸收或放出能量 |
| D、吸收能量或放出能量的过程,一定是化学变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
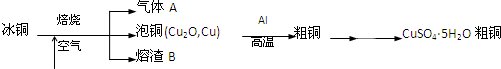
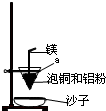
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com