
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是
A.提倡使用一次性发泡塑料餐具和塑料袋
B.食用的蛋白质、淀粉和脂肪都是高分子化合物
C.大力开发和应用氢能源有利于实现“低碳经济”
D.绿色化学的核心是应用化学原理治理环境污染
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届山西省高三上学期10月月考化学试卷(解析版) 题型:填空题
过渡金属元素铁能形成多种配合物,如:Fe(CO)x等。
1.①基态Fe3+的M层电子排布式为 .
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则 x= . Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型).
2.O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 .已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm.(用含ρ、NA的计算式表示)
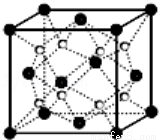
3.下列说法正确的是
A. 第一电离能大小:S>P>Si
B. 电负性顺序:C<N<O<F
C. 因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D. SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E. 分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
查看答案和解析>>
科目:高中化学 来源:2016届河北省保定市高三上学期摸底考试化学试卷(解析版) 题型:填空题
(14分)对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
请回答以下问题:
(1)硫酸工厂的酸性废水中砷(As)元素(主要以弱酸H3As03形式存在)含量极高,为控制砷的排放,某工厂采用化学沉降法处理含砷废水。
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为 ,AsH3的稳定性比NH3的稳定性 (填“强’’或“弱’’)。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成难溶的三硫化二砷,该反应的离子方程式为 。
(2)今年8月1 2日晚,天津滨海新区危险品仓库发生爆炸事故,少量氰化物因爆炸冲击发生泄漏,CN一有剧毒,泄露会污染水源和空气,需要处理。
①包知HCN为一元弱酸,则NaCN溶液的pH 7(填“>”“=”或“<”)。
②处理含CN一废水的方法之一是在微生物的作用下,CN-被氧气氧化成HC03一,同时生成NH3,该反应的离子方程式为
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如右图所示(图中“HA’’表示乳酸分子,A--表示乳酸根离子)。
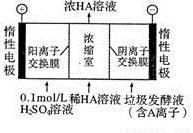
阳极的电极反应式为 简述浓缩室中得到浓乳酸的原理
查看答案和解析>>
科目:高中化学 来源:2016届浙江省新安江校区高三上学期第二次模拟化学试卷(解析版) 题型:选择题
用14C标记的一种C60羧酸衍生物,在特定条件下会断裂DNA抑制艾滋病毒的繁殖。以下有关14C的叙述正确的是
A.与12C60的碳原子化学性质不同 B.与15N含的中子数相同
C.与12C60互为同素异形体 D.与12C、13C互为同系物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上学期期中必修化学试卷(解析版) 题型:选择题
向500mL稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出NO气体5.6L(标准状况),同时溶液质量增加9.3g,下列判断正确的是
A.原溶液中投入铁粉物质的量是0.25mol
B.原溶液中的HNO3浓度是2.0mol/L
C.反应后的溶液中还可以溶解9.6g铜
D.反应后的溶液中c(Fe2+):c(Fe3+)=1:2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上学期半期考试化学试卷(解析版) 题型:选择题
3月22日是“世界水日”,下列有关水的叙述正确的是
A.长期饮用蒸馏水对身体有益 B.电解水时,正极产生的气体是氢气
C.利用蒸馏方法可以淡化海水 D.水直接由氢原子和氧原子构成
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省清远市高二上学期10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
(1)增加水的量或升高温度,一定可以加快镁跟水的反应速率
(2)增大硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
(3)对于反应CaCO3(s) 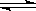 CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对于反应3H2(g) + N2(g) 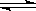 2NH3(g),在密闭容器中进行(固定体积),现充入氦气,由于容器中压强增大,则化学反应速率加快
2NH3(g),在密闭容器中进行(固定体积),现充入氦气,由于容器中压强增大,则化学反应速率加快
(5)对于反应3H2(g) + N2(g) 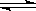 2NH3(g),使用适合催化剂,正逆反应速率同等程度加快
2NH3(g),使用适合催化剂,正逆反应速率同等程度加快
A.(1)(2) B.(1)(2)(3)
C.(1)(2)(3)(4) D.(5)
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期10月月考化学试卷(解析版) 题型:选择题
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是

A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C.c点到d点的反应中共转移0.6mol电子
D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
己知在碱性溶液中可发生如下反应:
2R(OH)3 + 3C1O- + 4OH- = 2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是
A.+3 B.+4 C.+5 D.+6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com