
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1,4 |
| 沉淀完全pH | 13 | 14 | 3.7 |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源:不详 题型:单选题
| A.利用太阳能,将海水蒸馏淡化 |
| B.加入明矾,使海水的盐份沉淀并淡化 |
| C.通直流电,采用电渗透法使海水淡化 |
| D.通过离子交换膜,除去所含的盐分使海水淡化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.⑤⑥⑦⑧ | C.③④⑤⑥ | D.除①②外 |
查看答案和解析>>
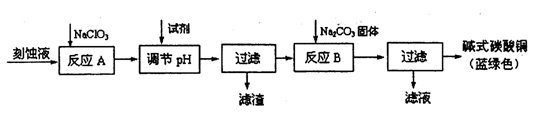
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
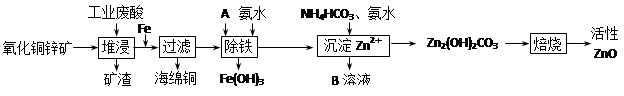
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
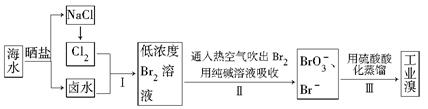
科目:高中化学 来源:不详 题型:填空题
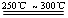 Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
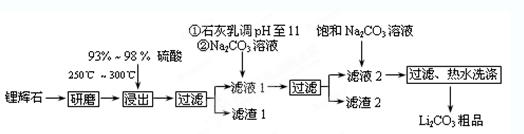
科目:高中化学 来源:不详 题型:单选题
| A.溴离子具有氧化性 | B.溴离子的还原性比氯离子弱 |
| C.该反应属于复分解反应 | D.氯气的氧化性比溴单质强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将明矾加入海水中静置过滤是海水淡化的方法之一 |
| B.海水晒盐的过程发生复分解反应 |
| C.海水中提取镁的过程不涉及氧化还原反应 |
| D.从海水中提取铀等微量元素是海水资源综合利用研究方向之一 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com