
【题目】设NA为阿伏加德罗常数值。下列说法正确的是
A.12g![]() 的原子核内中子数为6NA
的原子核内中子数为6NA
B.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA
C.25℃时,1LpH=2的H2C2O4溶液中含H+的数目为0.02NA
D.标准状况下,2.24LCO2与足量Na2O2反应转移的电子数为0.1NA
【答案】D
【解析】
A.1个碳原子含有中子数:质量数-质子数=14-6=8,12 g![]() 有原子
有原子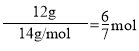 ,中子数为
,中子数为![]() ×8NA≠6NA,A项错误;
×8NA≠6NA,A项错误;
B.葡萄糖分子式C6H12O6、 蔗糖分子式C12H22O11,两种分子中碳、氢、氧三种元素的原子个数比分别为:1:2:1、12:22:11,含碳量不同,故混合物中的碳的质量无法确定,碳原子的数目无法确定,B项错误;
C. pH=2的H2C2O4溶液中c(H+)=0.01mol/L,1L H2C2O4溶液中H+的数目为0.01NA,C 项错误;
D. 2Na2O2+2CO2=2Na2CO3+O2,Na2O2即做还原剂又做氧化剂,当有1mol Na2O2反应时转移的电子数1mol,标准状况下,2.24L即0.1mol Na2O2反应时转移的电子数0.1mol,D项正确;
答案选D。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2=-58 kJ/mol
CH3OH(g)+H2O(g) △H2=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41 kJ/mol
CO(g)+H2O(g) △H3=+41 kJ/mol
回答下列问题:
(1)CO2的电子式是 。
(2)△H1= kJ/mol,①反应正向的熵变△S 0(填>、<或=)。
(3)在容积为2L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图,下列说法正确的是__________(填序号)
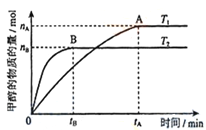
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tA mol/(L·min)
②当v(CH3OH) = v(H2O)时,说明反应达到平衡
③混合气体的平均相对分子质量A点大于B点
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入2L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;T1温度,反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的平衡常数数值为__________。
CO2(g)+3H2(g)的平衡常数数值为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的![]() 气体,且起始时体积相同。发生反应:
气体,且起始时体积相同。发生反应:![]() .一段时间后相继达到平衡状态下列说法中正确的是( )
.一段时间后相继达到平衡状态下列说法中正确的是( )
甲 乙
乙
A.平衡时![]() 体积分数:甲<乙
体积分数:甲<乙
B.达到平衡所需时间,甲与乙相等
C.该反应的平衡常数表达式![]() )
)
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】李克强总理在《2018年国务院政府工作报告》中强调“今年二氧化硫、氮氧化物排放量要下降3%。”研究烟气的脱硝(除NOx)、脱硫(除SO2)有着积极的环保意义。
Ⅰ.车排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。

(1)图中a、b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是_______(填“a”或“b”)
(2)在a曲线所示反应中,0~10min内,CO的平均反应速率v(CO)=_________;T℃时,该反应的化学平衡常数K=__________;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将移动_____________(填“向左”、“向右”或“不”)
(3)15min时, n (NO)发生图中所示变化,则改变的条件可能是_______(填序号)
A .充入少量COB .将N2液化移出体系C .升高温度D .加入催化剂
(4)Ⅱ. 已知有下列反应:
①5O2(g)+ 4NH3(g)![]() 6H2O(g)+ 4NO(g) △H1
6H2O(g)+ 4NO(g) △H1
②N2(g)+O2(g)![]() 2NO(g) △H2
2NO(g) △H2
③2NO(g)+ O2(g)![]() 2NO2(g) △H3
2NO2(g) △H3
若在高效催化剂作用下可发生8NH3(g)+ 6NO2(g)![]() 7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=_________(用△H1,△H2,△H3表示),△S__________0。
7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=_________(用△H1,△H2,△H3表示),△S__________0。
(5)某温度下,向某恒容密闭容器中充入一定量的NH3和NO2, 按照(4)的原理模拟污染物的处理。若容器中观察到________________(填序号),可判断该反应达到平衡状态
A .混合气体颜色不再改变
B .混合气体的密度不再改变
C .混合气体摩尔质量不再改变
D .NH3和NO2的物质的量之比不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学为了研究氯气的性质,做以下探究实验。向KI溶液通入氯气溶液变为黄色;继续通入氯气一段时间后,溶液黄色退去,变为无色;继续通入氯气,最后溶液变为浅黄绿色,查阅资料:I2+I-I3-,I2、I3-在水中均呈黄色。
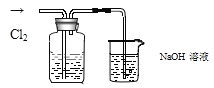
(1)为确定黄色溶液的成分,进行了以下实验:取 2~3 mL 黄色溶液,加入足量 CCl4,振荡静置,CCl4层呈紫红色,说明溶液中存在______,生成该物质的化学方程式为______,水层显浅黄色,说明水层显黄色的原因是______;
(2)继续通入氯气,溶液黄色退去的可能的原因______;
(3)NaOH 溶液的作用______,反应结束后,发现烧杯中溶液呈浅黄绿色,经测定该溶液的碱性较强,一段时间后溶液颜色逐渐退去,其中可能的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g) ![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
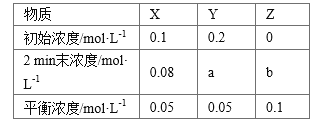
下列说法正确的是
A. 平衡时,X的转化率为20%
B. t ℃时,该反应的平衡常数为40
C. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
D. 前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,甲容器有一个移动活塞,能使容器保持恒压。起始时向甲中充入2 mol SO2、1 mol O2,向乙中充入4mol SO2、2 mol O2。甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,.关闭活塞K,使两容器中各自发生下述反应:2 SO2(g)+O2(g)![]() 2SO3(g)。达平衡时,甲的体积为0.8L。下列说法正确的是
2SO3(g)。达平衡时,甲的体积为0.8L。下列说法正确的是
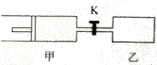
A.乙容器中SO2的转化率小于60%
B.平衡时SO3的体积分数:甲>乙
C.打开K后一段时间.再次达到平衡.甲的体积为1.4 L
D.平衡后向甲中再充入2mol SO2、1mol O2和3moLSO3,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古埃及人在公元前一千多年前曾用橄榄石(硅酸盐)作饰品,称它为“太阳的宝石”。某小组以某橄榄石(主要成分可看作为MgO、FeO和SiO2,还含有少量的MnO等)为原料制备工业合成氨的活性催化剂(FeO和Fe2O3质量比为9:20的混合物)的一种流程如下:

金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Mg2+ | 7.6 | 9.4 |
Fe2+ | 6.5 | 9.9 |
Fe3+ | 1.5 | 3.3 |
Mn2+ | 8.2 | 10.6 |
回答以下问题:
(1)从绿色化学角度分析,试剂1宜选择___(填字母)。加入试剂1的目的是___(用离子方程式表示)。
a.H2O2 b.MnO2 c.HNO3 d.K2Cr2O7
(2)调节pH范围为___。
(3)单位时间内“酸浸”中金属浸出率与温度、盐酸浓度的关系如图所示。

x___(填“>”“<”或“=”)2。当盐酸浓度相同时,温度高于45℃,浸出率降低的主要原因是___。
(4)“还原”过程中,不仅要控制温度,而且要控制氧化铁和炭粉(C)的比例。若“还原”时产生气体的相对分子质量为36,理论上,480kgFe2O3需要加入___kg炭粉(C)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-="==" Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com