
| A. | 该反应中,氧元素氧化了硫元素 | |
| B. | 该反应从电子转移角度看,每生成6 molCu,转移电子12 mol | |
| C. | 该反应中,Cu2S既是还原剂又是氧化剂 | |
| D. | 该反应从电子转移角度看,与SO2+2H2S=3S↓+2H2 O是同一反应类型 |
分析 Cu2S+2Cu2O═6Cu+SO2↑中,Cu元素的化合价降低,S元素的化合价升高,以此来解答.
解答 解:A.O元素的化合价不变,Cu元素的化合价降低,则Cu元素氧化硫元素,故A错误;
B.每生成6mol铜,转移电子为6mol×(1-0)=6mol,故B错误;
C.Cu元素的化合价降低,S元素的化合价升高,则Cu2S既是还原剂又是氧化剂,故C正确;
D.Cu2S+2Cu2O═6Cu+SO2↑中,Cu、S元素的化合价变化,而SO2+2H2S═3S+2H2O中只有S元素的化合价变化,电子转移的类型不同,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

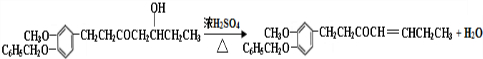 .
. 或
或 ,1mol该物质在一定条件下与足量的NaOH溶液反应,需要的NaOH的物质的量是3或2mol.
,1mol该物质在一定条件下与足量的NaOH溶液反应,需要的NaOH的物质的量是3或2mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(5) | B. | (1)(3)(5) | C. | (1)(4)(5) | D. | (2)(3)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、NO3-、Cl- | B. | NH4+、K+、HCO3-、OH- | ||
| C. | Na+、Al3+、AlO2-、Cl- | D. | K+、Mg2+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的简单离子还原性大于D | |
| B. | D元素只能以化合态存在于自然界中 | |
| C. | A元素所形成离子的半径有可能大于He原子的半径 | |
| D. | B、D的原子不能相互结合形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
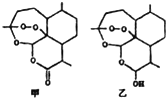 2015年我国药学家屠呦呦因创制青蒿素与双氢青蒿素用于治疗疟疾获得诺贝尔科学奖.图甲为青蒿素分子的结构简式,乙为双氢青蒿素分子的结构简式,其活性结构为分子中的“-O-O-”.下列说法错误的是( )
2015年我国药学家屠呦呦因创制青蒿素与双氢青蒿素用于治疗疟疾获得诺贝尔科学奖.图甲为青蒿素分子的结构简式,乙为双氢青蒿素分子的结构简式,其活性结构为分子中的“-O-O-”.下列说法错误的是( )| A. | 甲分子式为C15H22O5 | |
| B. | 甲、乙分子中均只存在2个六元环 | |
| C. | 甲转化成乙后水溶性增强 | |
| D. | 甲、乙分子中的活性结构“-O-O-”具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素周期表的种类相当多,如大象式、回路式、能级式、亚历山大式等,教材上所附的长式周期表是目前使用最普遍的周期表.有一种非常有趣的商业周期表如图所示.试回答下列问题:
元素周期表的种类相当多,如大象式、回路式、能级式、亚历山大式等,教材上所附的长式周期表是目前使用最普遍的周期表.有一种非常有趣的商业周期表如图所示.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com