
【题目】图中甲、乙、丙表示某动物细胞中的不同化合物,下列叙述正确的是( )

A. 核糖核苷酸是构成物质甲的基本单位
B. 物质甲为该生物的主要遗传物质
C. 物质丙是构成细胞的基本骨架
D. 物质乙的种类和数量与细胞膜的功能密切相关
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列结构图中,●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键。示例:(图中F2)根据各图表示的结构特点,下列有关叙述正确的是( )

A. 上述结构图中共出现6种元素 B. 甲、乙、丙为非极性分子,丁为极性分子
C. 甲与丁可以发生化合反应生成离子化合物 D. 向CaCl2溶液中通入丙有白色沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种常见元素结构信息如下表,试根据信息回答有关问题:

(1)写出B原子的基态电子排布式__;
(2)用氢键表示式写出A的氢化物溶液中存在的氢键__(任写一种);A的氢化物分子结合一个H+形成阳离子后,其键角__(填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为__,简要描述该配合物中化学键的成键情况__;
(4)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“”表示没有形成共价键的最外层电子,短线表示共价键.

在以上分子中,中心原子采用sp3杂化形成化学键是__(填写序号);在②的分子中有__个σ键和__个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。
2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。

(1)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线__________。
(2)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol。则反应向_________反应方向进行(填“正”或“逆”)。判断依据是_______。反应达到平衡后,各物质的体积分数与原平衡相比_______(填序号)。
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离常数 | 1.7×10-5 | K1=4.3×10-7,K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________。
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为______。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填序号),一定不变的是________(填序号)。一定变大的是________(填序号),
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E. c(CH3COO-)·c(H+)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示阴阳膜组合电解装置用于循环脱硫,用NaOH溶液在反应池中吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解又制得NaOH。其中a、b离子交换膜将电解槽分为三个区域,电极材料为石墨,产品C为H2SO4溶液。下列说法正确的是( )

A. b为只允许阳离子通过的离子交换膜
B. 阴极区中B最初充入稀NaOH溶液,产品E为氧气
C. 反应池采用气、液逆流方式,目的是使反应更充分
D. 阳极的电极反应式为SO32-+2e-+H2O===2H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸锂电池应用广泛, 电池放电后负极材料主要含有Li4Ti5O12、 铝箔及少量Fe, 可通过下列工艺流程回收钛、 锂。回答下列问题:

(1) Li4Ti5O12中, Ti元素的化合价为___, 滤液1中含金属的阴离子是___(填离子符号)。
(2) 酸浸时 Li4Ti5O12发生的反应是: Li4Ti5O12+7H2SO4+5H2O2=2Li2SO4+5[TiO(H2O2)]SO4+7H2O, 该反应是否属于氧化还原反应?___(填 “是” 或 “否”); 滤渣1是___。
(3) 向[TiO(H2O2)]SO4溶液中加入Na2SO3溶液发生反应的离子方程式为___。
(4) 向TiOSO4溶液中通入NH3发生反应的离子方程式为___。
(5) 沉淀TiO(OH)2用蒸馏水洗涤的目的是___。
(6) 萃取时, 温度对萃取率的影响如图所示。由图分析知实验时选择在常温下进行即可, 理由是__。

(7)“萃取” 和 “反萃取” 可简单表示为:[TiO(H2O2)]2++2(HA)2![]() [TiO(H2O2)](HA2)2+2H+,则反萃取过程中加入的试剂X是___。
[TiO(H2O2)](HA2)2+2H+,则反萃取过程中加入的试剂X是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3-四氢呋喃甲醇是合成农药呋虫胺的中间体,其合成路线如下:

已知:① RCl ![]() NCN
NCN ![]() RCOOH
RCOOH
② R1COOR2 + R318OH ![]() R1CO18OR3 + R2OH
R1CO18OR3 + R2OH
③ R1COOR2 ![]() R1CH2OH + R2OH
R1CH2OH + R2OH
请回答下列问题:
(1)A生成B的反应类型是__________,B中含有的官能团是___________。
(2)D发生酯化反应生成E的化学方程式为___________。
(3)3-四氢呋喃甲醇有多种同分异构体,请写出其中两种符合下列条件的有机物的结构简式:______________________。
①能发生水解反应 ②分子中有3个甲基
(4)G的结构简式为__________。
(5)生成G的过程中常伴有副反应发生,请写出一定条件下生成高分子聚合物的化学方程式:________。
(6)还可以利用![]() 与K发生加成反应合成3-四氢呋喃甲醇,写出K和H的结构简式。___________________、__________________。
与K发生加成反应合成3-四氢呋喃甲醇,写出K和H的结构简式。___________________、__________________。
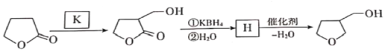
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)与N2O4是火箭发射中最常用的燃料与助燃剂,回答下列问题:
(1)T℃时,将一定量的NO2或N2O4充入一个容积为2L的恒容密闭容器中,发生反应2NO2(g)![]() N2O4(g),保持温度不变,各物质的浓度随时间变化关系如下表:
N2O4(g),保持温度不变,各物质的浓度随时间变化关系如下表:

①c(Y)代表___________(填化学式)的浓度,20~40s内,用NO2表示的化学反应速率为___________。
②该反应的平衡常数K=___________。
③60s时容器内混合气体的密度为_____g·L-1。
④100s时改变的条件是___________,重新达到平衡时,与原平衡比较,NO2的体积分数将___________(填“增大”“减小”或“不变”)。
(2)①已知2N2H4(g)+N2O4(g)![]() 3N2(g)+4H2O(g) △H=-QkJ·mol-1,相关化学键的键能如表所示。
3N2(g)+4H2O(g) △H=-QkJ·mol-1,相关化学键的键能如表所示。

使 1molN2O4(g)完全分解成相应的原子时需要吸收的能量是___________kJ(用代数式表示)

②相同温度下,向Ⅰ、Ⅱ、Ⅲ三个恒压密闭容器中均充入1molN2H4(g)和1molN2O4(g),三个容器的反应压强分别为p1、p2、p3。在其它条件相同的情况下,反应进行到tmin时,N2的体积分数如图所示,此时容器I___________(填“处于”或“不处于”)化学平衡状态,原因是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com