
【题目】下列事实中,不能用勒夏特列原理来解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 红棕色的NO2,加压后颜色先变深后变浅
C. 含酚酞的氨水溶液,微热后红色变深
D. H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
【答案】D
【解析】
勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
A、气体的溶解度随温度的升高而减小,随压强的增大而增大,由气体的溶解度随压强的增大而增大,因此常温时打开汽水瓶时,瓶内的压强减小,因此瓶内的二氧化碳会从瓶中溢出,可以用勒夏特列原理解释,故A不选;
B、2NO2![]() N2O4,加压后NO2浓度先变大,颜色变深,然后平衡正确向移动,颜色后变浅,能用勒夏特利原理解释,故B不选;
N2O4,加压后NO2浓度先变大,颜色变深,然后平衡正确向移动,颜色后变浅,能用勒夏特利原理解释,故B不选;
C、NH3·H2O![]() NH4++OH-,加热促进平衡正向进行,含酚酞的氨水溶液,微热后红色变深,能用勒夏特利原理解释,故C不选;
NH4++OH-,加热促进平衡正向进行,含酚酞的氨水溶液,微热后红色变深,能用勒夏特利原理解释,故C不选;
D、由H2、I2(g)、HI气体组成的平衡,反应前后气体体积不变,减压后平衡不动,体积增大颜色变浅,不能用勒夏特列原理解释,故D选;
故选D。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】燃煤烟气中含有大量SO2和NO,某科研小组研究SO2和NO的吸收方法。
回答下列问题:
(1)已知SO2(g)+O3(g) ![]() SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
NO(g)+O3(g) ![]() NO2(g)+O2(g) △H2=-199.8kJ· mol-1
NO2(g)+O2(g) △H2=-199.8kJ· mol-1
则反应SO3(g)+NO(g) ![]() SO2(g)+NO2(g)的△H=________kJ· mol-1
SO2(g)+NO2(g)的△H=________kJ· mol-1
(2)在恒温条件下,向2L恒容密闭容器中加入1 molNO和1molO3发生反应NO(g)+O3(g) ![]() NO2(g)+O2(g),2min时达到平衡状态。
NO2(g)+O2(g),2min时达到平衡状态。
①若测得2min内v(NO)=0.21 mol· L-1· min-1,则平衡时NO的转化率α1=________;若其它条件保持不变,在恒压条件下进行,则平衡时NO的转化率α2________α1(填“>”“<”或“=”)
②保持温度不变,向2min后的平衡体系中再加入0.3 moNO2和0.04 molNO,此时平衡将向________(填“正”或“逆”)方向移动
③该反应的逆反应速率与时间的关系如下图所示,反应在t1、t3、t5时刻均达到平衡状态。t2、t6时刻都只改变了某一个条件,则t2时刻改变的条件是________,t6时刻改变的条件是________,t4时刻改变条件后v(正) ________v(逆)(填“>”“<”或“=”)

(3)处理烟气中SO2也可采用碱液吸收法。已知25℃时,K(NH3·H2O)=1.8×10-5;H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-![]() CaSO4↓+2NH3·H2O。
CaSO4↓+2NH3·H2O。
①25℃时,0.1mol·L-1(NH4)2SO3溶液呈________ (填“酸性”“碱性”或“中性”)。
②计算第2步反应的平衡常数K=________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关四个常用电化学装置的叙述中,正确的是![]()
![]()
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ氢氧燃料电池 |
A. 图Ⅰ所示电池中,MnO2是正极,电极反应式是2H2O+2e-=H2↑+2OH-
B. 图Ⅱ所示电池放电过程中,当外电路通过1mol电子时,理论上负极板的质量增加96g
C. 图Ⅲ所示装置工作过程中,阳极质量减少量等于阴极的质量增加量
D. 图Ⅳ所示电池中,不管KOH溶液换成H2SO4溶液还是Na2SO4溶液,电池的总反应式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧硫酸铝铵晶体,发生的主要反应为4[NH4Al(SO4)2·12H2O] ![]() 2A12O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过下图所示的装置(假设试剂均过量)。下列说法正确的是
2A12O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过下图所示的装置(假设试剂均过量)。下列说法正确的是

A. 反应中硫元素既体现氧化性又体现还原性
B. 装置Ⅰ中可以观察到出现白色沉淀,其主要成分是BaSO4和BaSO3
C. 装置Ⅱ中可以观察到高锰酸钾紫色褪去
D. 将装置Ⅰ、Ⅱ顺序交换,仍能观察到相同的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氟的化合物在制造、化工等领域都有广泛应用。回答下列问题:
(1)基态铝原子的核外电子排布式为___________,占据最高能级的电子的电子云轮廓图形状为___________,基态铝原子比基态镁原子的第一电离能(I1)小,其原因是___________。
(2)通常情况下,AlF3可由六氟铝酸铵[(NH4)3AlF6]受热分解制得,请写出该反应的化学方程式______________________。
(3)AlF3具有较高的熔点(1040℃),属于___________晶体(填晶体类型);AlCl3在178℃时升华,写出导致AlF3、AlCl3具有不同晶体类型的原因(从原子结构与元素性质的角度作答)___________。
(4)NaAlO2在水溶液中实际上都是以Na[Al(OH)4]形式存在。其中[Al(OH)4]-为配离子,写出Al原子的杂化形式___________,该阴离子中存在的化学键有___________(填字母代号)
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位健 F.氢键
(5)萤石CaF2晶体的晶胞如图所示,其中Ca2+的堆积方式称为___________。立方体边长为acm,阿伏加德罗常数的值为NA,则CaF2晶体的密度为___________g·cm-3(列出计算式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分为Al2O3、SiO2,还含少量Fe2O3等)为原料制取氧化铝的部分工艺流程如下:
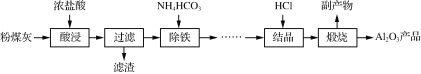
(1)“酸浸”过程发生的主要反应的离子方程式是_______________________________________________。
“酸浸”在恒容密闭反应釜中进行,温度不宜过高的原因是________________________________________________________________________。
(2)“除铁”生成Fe(OH)3的离子方程式为_________________,检验溶液中铁元素已经除尽的方法是________________________________________________________________________。
(3)“结晶”是向浓溶液中通入HCl气体,从而获得AlCl3·6H2O晶体的过程,溶液中Al3+和盐酸的浓度随通气时间的变化如下图所示。Al3+浓度减小的原因是_________________________。

(4)上述流程中,可以循环利用的物质是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14%的KNO3溶液与30.0g质量分数为24%的KNO3溶液混合,得到密度为1.15g/cm3的混合溶液。计算:
(1)混合后溶液中KNO3的质量分数为____,物质的量浓度为_____。
(2)在1000g水中需溶解____molKNO3才能使其浓度恰好与上述混合溶液的浓度相等。
(3)标准状况下44.8LHCl溶于水配成500mL溶液。则其浓度为_____,100mL该溶液与足量NaHCO3反应,生成气体在标准状况下为_____L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com