
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中进行,达到平衡状态的标志是
2NO+O2在恒容密闭容器中进行,达到平衡状态的标志是
①单位时间生成n mol O2,同时生成2n mool NO ②单位时间内生成n mol O2,同时生成2n mol NO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1 ④混合气体的颜色不再改变 ⑤混合气体的密度不再改变 ⑥混合气体的平均相对分子质量不再改变
A. ①③⑤ B. ②④⑥ C. ②③④ D. ③④⑤
【答案】B
【解析】
可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析。
①无论反应是否达到平衡状态,反应速率之比等于化学计量数之比,不能说明达到平衡状态,故①错误;②单位时间内生成n mol O2,同时生成2n molNO2,说明反应v正=v逆,达到平衡状态,故②正确;③化学反应进行到任何程度,化学反应速率之比均等于方程式的系数之比,所以用NO2、NO、O2表示的反应速率的比为2:2:1的状态不一定是平衡状态,故③错误;④混合气体颜色不再改变,证明二氧化氮的浓度不随时间的改变而改变,证明达到了平衡状态,故④正确;⑤混合气体密度ρ=![]() ,质量在反应前后是守恒的,体积保持不变,所以密度自始至终都不变,所以混合气体密度不改变的状态不一定是平衡状态,故⑤错误;⑥混合气体平均相对分子质量M=
,质量在反应前后是守恒的,体积保持不变,所以密度自始至终都不变,所以混合气体密度不改变的状态不一定是平衡状态,故⑤错误;⑥混合气体平均相对分子质量M=![]() ,质量在反应前后是守恒的,反应是一个前后气体系数和变化的反应,即n是变化的,所以M不变证明反应达到了平衡状态,故⑥正确。答案选B。
,质量在反应前后是守恒的,反应是一个前后气体系数和变化的反应,即n是变化的,所以M不变证明反应达到了平衡状态,故⑥正确。答案选B。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分为 CuFeS2)冶炼铜的主要流程如下。下列说法不正确的是

A. 气体A中的大气污染物可用氨水吸收并回收利用
B. 由泡铜冶炼粗铜的化学方程式为3Cu2O+2Al ![]() Al2O3+6Cu
Al2O3+6Cu
C. 加入石英砂作为添加剂熔剂,生成更稳定、更容易分离的硅酸盐
D. 用过量稀H2SO4可全部溶解熔渣B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。
(1)+6价的Cr能引起细胞的突变而对人体不利,可用亚硫酸钠将其还原。离子反应方程式为:3SO32-+Cr2O72-+8H+===2Cr3++3SO42-+4H2O,该反应氧化剂和还原剂的物质的量之比为___________。
(2)工业上利用铬铁矿( FeO. Cr2O3)冶炼铬的工艺流程如图所示:

①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________。
②水浸Ⅰ要获得浸出液的操作是___________。
③浸出液的主要成分为Na2CrO4,加入Na2S反应后有Na2SO4生成,则操作Ⅱ发生反应的离子方程式为___________。
(3)常温下Cr(OH)3的溶度积Ksp=1×10-32,若要使Cr3+完全沉淀pH为___________[c(Cr3+)降至10-5mol·L-1可认为完全沉淀]。
(4)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42-+2H+=Cr2O72-+H2O)。

①阳极的电极反应式为___________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由amol变为bmol,则生成重铬酸钠的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。
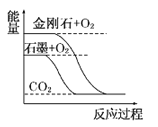
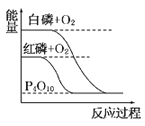
据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关化学反应的判断下列说法中正确的是
A. 常温下,放热反应一般都能自发进行.而吸热反应都不能自发进行
B. 反应NH4HCO3(s)![]() NH3(g)+H2O(g)+CO2(g) ΔH= +185.57 kJ· mol-1,在低温条件下不自发,但在高温条件下能自发
NH3(g)+H2O(g)+CO2(g) ΔH= +185.57 kJ· mol-1,在低温条件下不自发,但在高温条件下能自发
C. 自发反应一定都能发生,而非自发发应在任何条件下都不能发生
D. 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关四个常用的电化学装置的叙述,正确的是( )
A.图 所示碱性锌锰电池中,MnO2是催化剂
所示碱性锌锰电池中,MnO2是催化剂
B.图 所示铅蓄电池放电过程中,硫酸浓度保持不变
所示铅蓄电池放电过程中,硫酸浓度保持不变
C.图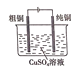 所示电解精炼铜装置工作过程中,电解质溶液中Cu2+浓度不断增大
所示电解精炼铜装置工作过程中,电解质溶液中Cu2+浓度不断增大
D.图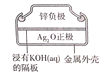 所示纽扣式锌银电池工作过程中,外电路中电子由锌极流向氧化银极
所示纽扣式锌银电池工作过程中,外电路中电子由锌极流向氧化银极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法不正确的是

A. 过程Ⅰ得到的Li3N中N元素为-3价
B. 过程Ⅱ生成W的反应:Li3N+3H2O===3LiOH+NH3↑
C. 过程Ⅲ中能量转化的形式:化学能转变为电能
D. 过程Ⅲ涉及到反应:4OH-4 e-=== O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HA溶液与BOH 溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH 的关系如图所示。下列说法正确的是

A. 由图可知BOH 一定是强碱 B. Ka(HA)=1×10-6mol/L
C. b点时,c(B-)=c(A-)=c(OH-)=c(H+) D. a→b过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) △H1
O2(g)=H2O(g) △H1
![]() N2(g)+O2(g)=NO2(g) △H2
N2(g)+O2(g)=NO2(g) △H2
![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) △H3
H2(g)=NH3(g) △H3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的△H为
O2(g)=2NO2(g)+3H2O(g)的△H为
A. 2△H1+2△H2-2△H3 B. △H1+△H2-△H3
C. 3△H1+2△H2+2△H3 D. 3△H1+2△H2-2△H3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com