
一定能在下列溶液中大量共存的离子组是( )
A.含有大量Al3+的溶液:Na+、NH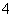 、SO
、SO 、Cl-
、Cl-
B.c(H+)=1×10-13 mol/L的溶液:Na+、Ca2+、SO 、CO
、CO
C.含有大量Fe3+的溶液:Na+、Mg2+、NO 、SCN-
、SCN-
D.含有大量NO 的溶液:H+、Fe2+、SO
的溶液:H+、Fe2+、SO 、Cl-
、Cl-
科目:高中化学 来源: 题型:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一种中强酸,写出其电离方程式:_____________________________
________________________________________________________________________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
③NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显________(填“弱酸性”“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:____________________________________________。
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
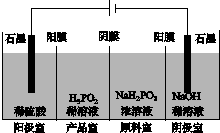
①写出阳极的电极反应式:_________________________________________。
②分析产品室可得到H3PO2的原因:_____________________________________
________________________________________________________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
M、N为短周期的两种元素,M元素原子的最外层电子数≤4,N元素原子的最外层电子数>4,下列对其中说法正确的是
A.M、N可能为金属
B.若M、N为同周期元素,则原子半径M<N
C.M、N元素的单质可能与水发生置换反应
D.M、N形成的离子化合物不能体现强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g)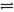 CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。
①已知:CH4(g)+3/2O2(g)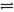 CO(g)+2H2O(g) △H1
CO(g)+2H2O(g) △H1
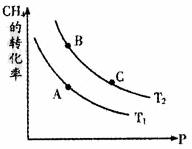
H2(g)+1/2O2(g)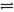 H2O(g) △H2
H2O(g) △H2
 则CH4(g)+H2O(g)
则CH4(g)+H2O(g)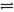 CO(g)+3H2(g)的△H=_____(用含△H1、△H2的式子表示)
CO(g)+3H2(g)的△H=_____(用含△H1、△H2的式子表示)
②一定条件下反应CH4(g)+H2O(g)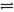 CO+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1,则上述反应的△H________0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA________KB。
CO+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1,则上述反应的△H________0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA________KB。
③维持温度T2,将0.04mol CH4(g)和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=___________,下列现象能说明该反应已经达到平衡状态的是___________(填写序号)

④在上述B点平衡基础上,向容器中再通入a mol CH4和a mol H2O气体,使之在C点重新达平衡,此时测得CO有0.03 mol,则a=______________。
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+1/2O2(g)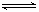 CO2(g)降低其浓度。
CO2(g)降低其浓度。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
| 容器编号 | c(CO)/mol·L-1 | c(O2)/mol·L-1 | c(CO2)/mol·L-1 | v (正)和v (逆)比较 |
| I | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v (正)= v (逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v (正)_____v (逆) |
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5mol/L和1.0×10-4mol/L。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol/L,则最终尾气中CO的浓度为________________mol/L(请保留两位有效数字)。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为____________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列溶液中不能大量共存的离子组是( )
①NH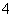 、Ag+、PO
、Ag+、PO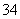 、Cl-
、Cl-
②Fe3+、H+、I-、HCO
③Al3+、Mg2+、SO 、CO
、CO
④在pH=12的溶液中,K+、Cl-、HCO 、Na+
、Na+
⑤在pH=0的溶液中,Na+、NO 、SO
、SO 、K+
、K+
A.仅①③④ B.仅①②③
C.全部 D.仅①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
与金属铝反应只能放出氢气,且能大量共存的离子组是( )
A.NH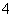 、NO
、NO 、CO
、CO 、Na+
、Na+
B.Na+、H+、Cl-、SO
C.NO 、K+、Cl-、OH-
、K+、Cl-、OH-
D.AlO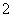 、K+、OH-、Al3+
、K+、OH-、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH 、Cl-、S2-
、Cl-、S2-
B.酸性溶液中可能大量存在Na+、ClO-、SO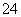 、I-
、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO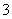
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO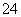
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活息息相关,下列叙述错误的是( )
A.铁表面镀锌可增强其抗腐蚀性
B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
C.大量燃烧化石燃料是造成雾霾天气的一种重要因素
D.含重金属离子的电镀废液不能随意排放
查看答案和解析>>
科目:高中化学 来源: 题型:
最新执行的国家食品卫生标准规定,酱油中3-氯丙醇(ClCH2CH2CH2OH)含量不得超过1ppm。相对分子质量为94.5的氯丙醇(不含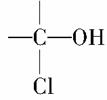 )共有( )
)共有( )
A.2种 B.3种
C.4种 D.5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com