
| A. |  | B. |  | C. |  | D. |  |
科目:高中化学 来源: 题型:解答题
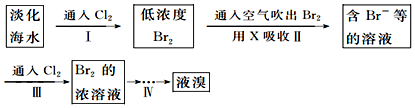
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7, |
| K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖、油脂、蛋白质都可以生水解反应 | |
| B. | 天然纤维、聚酚纤维、光导纤维都属于有机高分子材料 | |
| C. | 大力实施矿物燃料脱硫、脱硝技术以减少硫、氮氧化物排放 | |
| D. | 镀锌铁或镀锡铁镀层破损后仍将通过牺牲阳极的阴极保护法防止腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
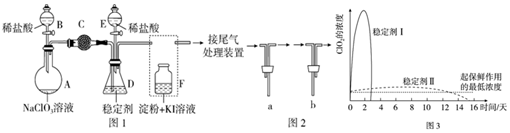
 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
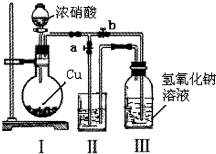
| A. | Zn片是正极,Cu片是负极 | B. | 电流方向是从Zn经外电路流向Cu | ||
| C. | 电解液的PH保持不变 | D. | Cu片上有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,1 L 0.50 mol•L-1 NH4Cl溶液与2 L 0.25 mol•L-1 NH4Cl溶液含NH+4物质的量不同 | |
| B. | 1L1mol/L的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子 | |
| D. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA个氢原子. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{81}^{203}$Tl 和 ${\;}_{81}^{205}$Tl 质子数相同 | |
| B. | ${\;}_{81}^{203}$Tl 和 ${\;}_{81}^{205}$Tl互为同素异形体 | |
| C. | ${\;}_{81}^{203}$Tl 和 ${\;}_{81}^{205}$Tl中子数之差为2 | |
| D. | ${\;}_{81}^{205}$Tl 原子核内中子数与核外电子数之差为43 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com