
A、 烧杯中通入过量的CO2,出现白色沉淀,则溶液中一定含有AlO2- 烧杯中通入过量的CO2,出现白色沉淀,则溶液中一定含有AlO2- |
B、 装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、氧化性 装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、氧化性 |
C、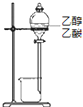 装置可以除去乙醇中的乙酸 装置可以除去乙醇中的乙酸 |
D、 装置可以比较碳酸钠、碳酸氢钠的热稳定性 装置可以比较碳酸钠、碳酸氢钠的热稳定性 |


科目:高中化学 来源: 题型:
 室温下,把SiO2超细粉置入蒸馏水中,不断搅拌至平衡,形成 H4SiO4溶液,反应原理如下:SiO2(s)+2H2O(l)?H4SiO4(aq)△H.
室温下,把SiO2超细粉置入蒸馏水中,不断搅拌至平衡,形成 H4SiO4溶液,反应原理如下:SiO2(s)+2H2O(l)?H4SiO4(aq)△H.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 磷酸毗醛基素是细胞重要组成部分,可视为磷酸(分子中有3个羟基)形成的酯,其结构式如图,下列说法错误的是( )
磷酸毗醛基素是细胞重要组成部分,可视为磷酸(分子中有3个羟基)形成的酯,其结构式如图,下列说法错误的是( )| A、能与金属钠反应 |
| B、能使石蕊试液变红 |
| C、能发生银镜反应 |
| D、1 mol 该酯与NaOH溶液反应,最多消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | Na+ | K+ | Ca 2+ | Mg 2+ | Cl- | SO4 2- | HCO3- |
| 含量/mg?L-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |

查看答案和解析>>
科目:高中化学 来源: 题型:

| 离子 | Na+ | Mg2+ | Cl- | SO2- |
| 浓度/(g?L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、H2R是二元弱酸,其Ka1=1×10-2 |
| B、当溶液恰好呈中性时,c( Na +)=2c ( R2-)+c( HR-) |
| C、NaHR在溶液中水解倾向大于电离倾向 |
| D、含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 石灰石(主要成分为CaCO3)是重要的工业原料,
石灰石(主要成分为CaCO3)是重要的工业原料,| 物理量/单位 实验序号 | m(CaCO3)/g | V(2mon?L-1HCl)/mL | V(H2O)/mL | |
| 1 | P | 20 | 0 | |
| 2 | P |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高Fe2(SO4)3溶液的温度,其中水的离子积常数和pH均增加 |
| B、相同温度下1L 0.1mol.L-1NaF溶液跟1L 0.1mol.L-1NaCl溶液中所含离子总数不相等 |
| C、在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液红色褪去,说明BaCl2溶液显酸性 |
| D、铅蓄电池放电时的负极和充电时的阴极匀发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com