
| 0.004mol-0.002mol |
| 0.1L+0.1L |
| 3V×x-2V×x |
| 5V |


科目:高中化学 来源: 题型:
| A、将10 g CaCO3粉末加入100 mL水中,所得溶液的浓度为l mol?L-1 |
| B、将100 mL 2 mol?L-1盐酸加热蒸发至50 mL,所得溶液的浓度为4 mol?L-1 |
| C、将l0 mL l.0mol?L-1NaCl溶液与90mL水混合,所得溶液的浓度为0.1 mol?L-1 |
| D、将10 g CaO加入100 mL饱和石灰水中,充分搅拌、静置并恢复到原来的温度,所得溶液的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定序号 | 待测溶液的体积/mL | 所耗NaOH标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.78 |
| 2 | 25.00 | 1.20 | 21.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入合金的质量可能为3.2g |
| B、参加反应的硝酸的物质的量为0.4mol |
| C、沉淀完全时消耗NaOH的物质的量为0.3mol |
| D、还原产物的体积范围2.24L<V还原产物<6.72L |
查看答案和解析>>
科目:高中化学 来源: 题型:
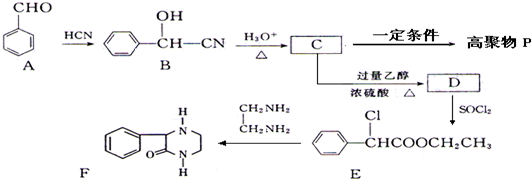
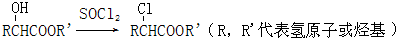
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、0.5 mol?L-1 |
| B、0.1 mol?L-1 |
| C、1 mol?L-1 |
| D、1.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
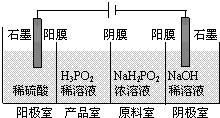
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O、H2S、H2Se、H2Te |
| B、C(CH3)4、CH(CH3)2CH2CH3、CH3(CH2)3CH3 |
| C、SiO2、NaCl、CCl4、SO2 |
| D、F2、Cl2、Br2、I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com