
【题目】研究化学反应的速率、限度及能量变化具有重要意义。
⑴实验室用锌粒和稀硫酸反应制氢气,能加快反应速率的方法有:______、______。
⑵工业上合成氨反应(N2+3H2![]() 2NH3)中物质的能量随时间的变化如下图所示。
2NH3)中物质的能量随时间的变化如下图所示。

①该反应为______(填“放热”或“放热”)反应。
②若起始N2和H2的体积比为1∶3,控制一定的条件,___(填“能”或“不能”)使反应物的转化率达到100%。
③下列过程放出热量的是______。(填字母)
A.甲烷燃烧
B.碳酸钙分解
C.液氨汽化
D.化学键断裂
⑶图为铜锌原电池示意图。

①原电池工作时的能量转化方式为______。
②原电池工作时,导线中电子的流向为______。
③Cu电极表面的现象为______。
【答案】加热 适当增大硫酸的浓度(或改锌粒为锌粉) 放热 不能 A 化学能转化为电能 由Zn(负极)到Cu(正极) 有气泡
【解析】
(1)加热升高温度,将锌粒粉碎为锌粉可以增大固体表面积,适当增大硫酸的浓度,向稀硫酸溶液中加入硫酸铜溶液或构成锌铜原电池等都能加快锌粒和稀硫酸反应制氢气的反应速率;
(2)①由图可知,反应物总能量大于生成物总能量;
②合成氨反应为可逆反应,可逆反应不可能完全进行;
③A、甲烷燃烧为放热反应;
B、碳酸钙受热分解为吸热反应;
C、液氨汽化是吸收能量的过程;
D、化学键断裂需要吸收能量;
(3)原电池是将化学能转化为电能的装置,原电池工作时,活泼金属锌做负极,铜做正极,电子由负极经导线流向正极。
(1)加热升高温度,将锌粒粉碎为锌粉可以增大固体表面积,适当增大硫酸的浓度,向稀硫酸溶液中加入硫酸铜溶液或构成锌铜原电池等扣能加快锌粒和稀硫酸反应制氢气的反应速率,故答案为:加热;适当增大硫酸的浓度(或改锌粒粉碎为锌粉);
(2)①由图可知,反应物总能量大于生成物总能量,则合成氨反应为放热反应,故答案为:放热;
②由题给合成氨反应的化学方程式可知,合成氨反应为可逆反应,可逆反应不可能完全进行,则反应物的转化率不能达到100%,故答案为:不能;
③A、甲烷燃烧为放热反应,反应放出能量,故正确;
B、碳酸钙受热分解为吸热反应,反应吸收能量,故错误;
C、液氨汽化是吸收能量的过程,故错误;
D、化学键断裂需要吸收能量,故错误;
A正确,故答案为:A;
(3)①原电池是将化学能转化为电能的装置,故答案为:化学能转化为电能;
②原电池工作时,活泼金属锌做负极,铜做正极,电子由负极经导线流向正极,故答案为:由Zn(负极)到Cu(正极);
③铜为原电池的正极,氢离子在铜表面得电子发生还原反应生成氢气,实验现象为有气泡逸出,故答案为:有气泡逸出。


科目:高中化学 来源: 题型:
【题目】(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量。
反应的热化学方程式为___________________________________________。
又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是___________kJ。
(2)已知: C(s)+ O2(g) = CO2(g) △H2=-393.5kJ/mol
H2(g)+1/2 O2(g) =H2O(g) △H3 = -241.8 kJ/mol
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中 C与 H2的物质的量之比为___________________。
(3)盖斯定律在生产和科学研究中有很重要的意义。现根据下列2个热化学方程式: Fe2O3(s)+3CO(g)=Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
Fe2O3(s)+CO(g)=2FeO(s)+CO2(g) ΔH=+411.2kJ/mol
写出CO(g)还原FeO(s)得到Fe(s)和CO2(g)的热化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置

请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)写出图中四种实验操作的名称:____、____、____、____。
(2)除去Ca(OH)2 溶液中悬浮的CaCO3__________;
(3)从碘水中提取碘__________;
(4)用自来水制取蒸馏水__________;
(5)分离植物油和水__________;
(6)除去粗盐中的泥沙__________;
(7)与海水晒盐原理相符的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2-、碳氢化合物大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:汽车尾气中的CO、NOx、碳氮化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol K1(该反应的平衡常数)
2C(s)+O2(g)=2CO(g) △H2=-221kJ/mol K2(同上)
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol K3(同上)
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式_________,以及该热化学方程式的平衡常数K=________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2 △H=-1200kJ/mol。
4CO2+N2 △H=-1200kJ/mol。
①某温度下,在2L密闭容器中充入0.lmolNO2和02m1CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时NO2的平均反应速率v(NO2)=_________mol/(L·s)。
②若容器中观察到____________________________,可判断该反应达到平衡状态;
③能使该反应的反应速率增大,且平衡向逆反应方向移动的是_______。
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
(3)电化学降解NO2-的原理如图:

阴极反应式为_____________________________________。
(4)在高效催化剂作用下可用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图。活化能最小的是________[用E(A)、E(B)、E(C)表示三种催化剂下该反应的活化能]。

②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图。试说明图中曲线先增大后减小的原因____________________________________________________(假设该温度范围内催化剂的催化效率相同)。
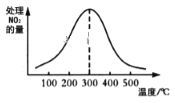
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:


已知:CaO2的制备原理:CaCl2+H2O2+2NH3H2O+6H2O= CaO28H2O↓+2NH4Cl
请回答下列问题:
(1)仪器C的名称为__________,支管B的作用____________;
(2)加入氨水的作用是_______;(从化学平衡移动的原理分析)
(3)过滤后洗涤沉淀的试剂最好用_______;
A.水 B.浓盐酸 C.无水乙醇 D.CaCl2溶液
(4)沉淀反应时常用冰水浴控制温度在O℃左右,其可能原因是_________、_______(写出两种)。
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法是:________________;
②准确称取0.50g样品,置于试管中加热使其完全分解,收集到44.80mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为________(保留4位有效数字);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出以下反应的化学反应方程式
①三氧化二铁与稀硫酸反应:______
②氢氧化铝药物治疗胃酸(主要成分为盐酸)过多:______
③氢氧化钠溶液吸收少量二氧化硫气体:______
(2)已知CO和CO2的混合气体18.0g在标准状况下所占的体积为11.2L。则该混合气体中,CO2的物质的量为____mol。
(3)在同温同压下,若A容器中的O2和B容器中的SO2所含的氧原子总数相等,则A容器和B容器的体积比是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 0.3mol·L-1A1(NO3)3溶液中含A13+数小于0.3NA
B. H2(g)+I2(g)![]() 2HI(g) △H=-akJ·mol-1,若向某密闭容器中加入NA个氢分子和NA个碘分子,则充分反应后放出的热量为akJ
2HI(g) △H=-akJ·mol-1,若向某密闭容器中加入NA个氢分子和NA个碘分子,则充分反应后放出的热量为akJ
C. 标准状况下,(-)Zn│H2SO4(1mol·L-1)│Cu(+)原电池中,当正极产生1.12LH2时,则外电路中通过的电子数为0.1NA
D. 常温常压下,28 g C2H4和CO的混合气体中含有碳原子的数目为1.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com