
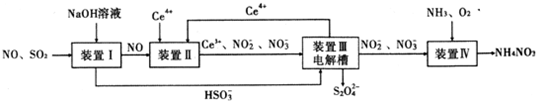
·ÖĪö ×°ÖĆ¢ńÖŠ¶žŃõ»ÆĮņŹĒĖįŠŌŃõ»ÆĪļ£¬ÄÜŗĶĒæ¼īĒāŃõ»ÆÄĘÖ®¼ä·¢Éś·“Ó¦£ŗSO2+OH-=HSO3-£¬NOŗĶĒāŃõ»ÆÄĘÖ®¼ä²»»į·“Ó¦£¬
×°ÖĆ¢ņÖŠNOŌŚĖįŠŌĢõ¼žĻĀ£¬NOŗĶCe4+Ö®¼ä»į·¢ÉśŃõ»Æ»¹Ō·“Ó¦£ŗNO+H2O+Ce4+=Ce3++NO2-+2H+£¬NO+2H2O+3Ce4+=3Ce3++NO3-+4H+£¬
×°ÖĆ¢óÖŠ£¬ŌŚµē½ā²ŪµÄŃō¼«2Ce3+-2e-=2Ce4+£¬Ņõ¼«µē¼«·“Ó¦Ź½ĪŖ£ŗ2HSO3-+2H++2e-=S2O42-+2H2O£¬
×°ÖĆ¢ōÖŠĶØČė°±Ęų”¢ŃõĘų£¬2NO2-+O2+2H++2NH3=2NH4++2NO3-£¬
£Ø1£©ŌŚĖįŠŌ»·¾³ĻĀ£¬NOŗĶCe4+Ö®¼ä»į·¢ÉśŃõ»Æ»¹Ō·“Ó¦£»
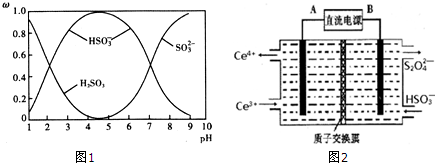
£Ø2£©¢ŁA£®pH=7Ź±£¬ČÜŅŗĪŖÖŠŠŌ£¬½įŗĻµēŗÉŹŲŗć·ÖĪö£»
B£®HSO3-?SO32-+H+£¬ÓÉĶ¼ÖŠŹż¾Ż£¬pH=7Ź±£¬c£ØHSO3- £©=c£ØSO32- £©£»
C£®ČÜŅŗµÄpHæŲÖĘŌŚ4”«5Ź±£¬c£ØHSO3- £©ÅضČ×ī“ó£»
D£®øł¾ŻÖŹ×ÓŹŲŗćÅŠ¶Ļ£»
¢ŚNaOHµÄĪļÖŹµÄĮæĪŖ1mol£¬øł¾Ż2NaOH+SO2ØTNa2SO3+H2OæÉÖŖ¶žŃõ»ÆĮņ¹żĮ棬¹żĮæ²æ·ÖµÄ¶žŃõ»ÆĮņŌŁ·¢Éś·“Ó¦Na2SO3+H2O+SO2ØT2NaHSO3£¬ŅĄ¾Ż·½³ĢŹ½½ųŠŠ¼ĘĖćn£ØSO32-£©£ŗn£ØHSO3-£©µÄ±Č£¬¾Ż“ĖŹéŠ“Ąė×Ó·½³ĢŹ½£»
¢ŪĖįŹ½µĪ¶Ø¹ÜÖ»ÄÜŹ¢·ÅĖįŠŌČÜŅŗ”¢¼īŹ½µĪ¶Ø¹ÜÖ»ÄÜŹ¢·Å¼īŠŌČÜŅŗ£»ĖįŠŌøßĆĢĖį¼Ų¾ßÓŠĒæŃõ»ÆŠŌ£¬ÄÜŃõ»Æ¼īŹ½µĪ¶Ø¹ÜĻšĘ¤¹Ü£»ŌČÜŅŗĪŽÉ«£¬KMnO4ĪŖ×ĻŗģÉ«£¬µ±ČÜŅŗÖŠµÄH2C2O4ŗĶKHC2O4·“Ó¦ĶźČ«Ź±£¬ČÜŅŗ³Ź×ĻŗģÉ«ĒŅ°ė·ÖÖÓŃÕÉ«²»±ä£»
£Ø3£©Éś³ÉCe4+ĪŖŃõ»Æ·“Ó¦£¬·¢ÉśŌŚŃō¼«ÉĻ£»·“Ó¦ĪļŹĒHSO3-±»»¹Ō³ÉS2O42-£¬µĆµ½µē×Ó£»
£Ø4£©NO2-µÄÅضČĪŖ0.4mol/L£¬ŅŖŹ¹1m3øĆČÜŅŗÖŠµÄNO2-ĶźČ«×Ŗ»ÆĪŖNH4NO3£¬ÉčĻūŗıźæöĻĀŃõĘųµÄĢå»żŹĒV£¬½įŗĻµē×ÓŹŲŗć½ųŠŠ¼ĘĖć£®
½ā“š ½ā£ŗ×°ÖĆ¢ńÖŠ¶žŃõ»ÆĮņŹĒĖįŠŌŃõ»ÆĪļ£¬ÄÜŗĶĒæ¼īĒāŃõ»ÆÄĘÖ®¼ä·¢Éś·“Ó¦£ŗSO2+OH-=HSO3-£¬NOŗĶĒāŃõ»ÆÄĘÖ®¼ä²»»į·“Ó¦£¬×°ÖĆ¢ņÖŠNOŌŚĖįŠŌĢõ¼žĻĀ£¬NOŗĶCe4+Ö®¼ä»į·¢ÉśŃõ»Æ»¹Ō·“Ó¦£ŗNO+H2O+Ce4+=Ce3++NO2-+2H+£¬NO+2H2O+3Ce4+=3Ce3++NO3-+4H+£¬×°ÖĆ¢óÖŠ£¬ŌŚµē½ā²ŪµÄŃō¼«2Ce3+-2e-=2Ce4+£¬Ņõ¼«µē¼«·“Ó¦Ź½ĪŖ£ŗ2HSO3-+2H++2e-=S2O42-+2H2O£¬×°ÖĆ¢ōÖŠĶØČė°±Ęų”¢ŃõĘų£¬2NO2-+O2++2H++2NH3=2NH4++2NO3-£¬
£Ø1£©×°ÖĆ¢ņÖŠNOŌŚĖįŠŌĢõ¼žĻĀNOŗĶCe4+Ö®¼ä»į·¢ÉśŃõ»Æ»¹Ō·“Ó¦£ŗNO+H2O+Ce4+=Ce3++NO2-+2H+£¬NO+2H2O+3Ce4+=3Ce3++NO3-+4H+£¬
¹Ź“š°øĪŖ£ŗNO+H2O+Ce4+=Ce3++NO2-+2H+£»
£Ø2£©¢ŁA£®pH=7Ź±£¬ČÜŅŗ³ŹÖŠŠŌ£¬c£ØH+£©=c£ØOH-£©£¬ČÜŅŗÖŠ“ęŌŚµēŗÉŹŲŗć£ŗc£ØH+£©+c£ØNa+£©=c£ØHSO3-£©+2c£ØSO32-£©+c£ØOH-£©£¬¹ŹČÜŅŗÖŠc£ØNa+£©=c£ØHSO3-£©+2c£ØSO32-£©£¬¹ŹAÕżČ·£»
B£®HSO3-?SO32-+H+£¬ÓÉĶ¼ÖŠŹż¾Ż£¬pH=7Ź±£¬c£ØHSO3- £©=c£ØSO32- £©£¬ÓÉKaµÄ±ķ“ļŹ½æÉÖŖ£¬H2SO3µÄµŚ¶ž¼¶µēĄėĘ½ŗā³£ŹżK2”Öc£ØH+£©=10-7£¬¹ŹBÕżČ·£»
C£®ČÜŅŗµÄpHæŲÖĘŌŚ4”«5Ź±£¬c£ØHSO3- £©ÅضČ×ī“ó£¬ŌņĪŖ»ńµĆ¾”æÉÄÜ“æµÄNaHSO3£¬æɽ«ČÜŅŗµÄpHæŲÖĘŌŚ4”«5×óÓŅ£¬¹ŹCÕżČ·£»
D£®ČÜŅŗ“ęŌŚÖŹ×ÓŹŲŗć£¬Ó¦ĪŖc£ØOH-£©=c £ØH+£©+c£ØHSO3-£©+2c£ØH2SO3£©£¬¹ŹD“ķĪó£»
¹Ź“š°øĪŖ£ŗABC£»
¢Ś1L1.0mol/LµÄNaOHČÜŅŗÖŠŗ¬ÓŠĒāŃõ»ÆÄʵÄĪļÖŹµÄĮæĪŖ£ŗ1L”Į1.0mol/L=1.0mol£¬13.44L£Ø±źæöĻĀ£©SO2£¬n£ØSO2£©=$\frac{13.44L}{22.4L/mol}$=0.6mol£¬
É跓Ӧɜ³ÉŃĒĮņĖįÄʵÄĪļÖŹµÄĮæĪŖx£¬ĻūŗĶžŃõ»ÆĮņµÄĪļÖŹµÄĮæĪŖy
2NaOH+SO2ØTNa2SO3+H2O
2 1 1
1.0mol y x
$\frac{2}{1.0mol}$=$\frac{1}{y}$=$\frac{1}{x}$½āµĆ£ŗx=0.5mol y=0.5moløł¾ŻÉĻŹö¼ĘĖćæÉŅŌÖŖµĄ£¬¶žŃõ»ÆĮņŹĒ¹żĮæµÄ£¬Ź£ÓąµÄ¶žŃõ»ÆĮņµÄĪļÖŹµÄĮæĪŖ£ŗ0.6mol-0.5mol=0.1mol
ĖłŅŌ¶žŃõ»ÆĮņ»įŗĶÉś³ÉµÄŃĒĮņĖįÄĘ¼ĢŠų·“Ó¦£¬
ÉčĻūŗÄŃĒĮņĖįÄʵÄĪļÖŹµÄĮæĪŖa£¬Éś³ÉŃĒĮņĖįĒāÄʵÄĪļÖŹµÄĮæĪŖb
Na2SO3+H2O+SO2ØT2NaHSO3
1 1 2
a 0.1mol b
$\frac{1}{a}$=$\frac{2}{b}$=$\frac{1}{0.3mol}$½āµĆ£ŗa=0.1mol b=0.2mol£¬
ŌņČÜŅŗÖŠn£ØSO32-£©=0.5mol-0.1mol=0.4mol£¬n£ØHSO3-£©=0.2mol£¬n£ØSO32-£©£ŗn£ØHSO3-£©=2£ŗ1£¬Ōņ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ3SO2+5OH-=2SO32-+HSO3-+2H2O£¬
¹Ź“š°øĪŖ£ŗ3SO2+5OH-=2SO32-+HSO3-+2H2O£»
¢ŪĖįŹ½µĪ¶Ø¹ÜÖ»ÄÜŹ¢·ÅĖįŠŌČÜŅŗ”¢¼īŹ½µĪ¶Ø¹ÜÖ»ÄÜŹ¢·Å¼īŠŌČÜŅŗ£¬ĖįŠŌøßĆĢĖį¼ŲČÜŅŗ³ŹĖįŠŌ£¬ŌņæÉŅŌŹ¢·ÅŌŚĖįŹ½µĪ¶Ø¹ÜÖŠ£»ŌČÜŅŗĪŽÉ«£¬¶ųKMnO4ĪŖ×ĻŗģÉ«£¬ĖłŅŌµ±ČÜŅŗÖŠµÄH2C2O4ŗĶKHC2O4·“Ó¦ĶźČ«Ź±£¬µĪČė×īŗóŅ»µĪČÜŅŗ³Ź×ĻŗģÉ«ĒŅ°ė·ÖÖÓŃÕÉ«²»±ä£»
¹Ź“š°øĪŖ£ŗĖįŹ½£»µĪČė×īŗóŅ»µĪČÜŅŗ³Ź×ĻŗģÉ«ĒŅ°ė·ÖÖÓŃÕÉ«²»±ä£»
£Ø3£©Éś³ÉCe4+ĪŖŃõ»Æ·“Ó¦£¬·¢ÉśŌŚŃō¼«ÉĻ£¬Ņņ“ĖŌŁÉśŹ±Éś³ÉµÄCe4+ŌŚµē½ā²ŪµÄŃō¼«£¬Į¬½ÓµēŌ“Õż¼«£¬·“Ó¦ĪļŹĒHSO3-±»»¹Ō³ÉS2O42-£¬µĆµ½µē×Ó£¬µē¼«·“Ó¦Ź½ĪŖ£ŗ2HSO3-+2H++2e-=S2O42-+2H2O£¬
¹Ź“š°øĪŖ£ŗÕż£»2HSO3-+2H++2e-=S2O42-+2H2O£»
£Ø4£©NO2-µÄÅضČĪŖ0.4mol/L£¬ŅŖŹ¹1m3øĆČÜŅŗÖŠµÄNO2-ĶźČ«×Ŗ»ÆĪŖNH4NO3£¬ŌņŹ§Č„µē×ÓŹżĪŖ£ŗ1000”Į£Ø5-3£©”Į0.4mol£¬ÉčĻūŗıźæöĻĀŃõĘųµÄĢå»żŹĒV£¬øł¾Żµē×ÓŹŲŗć£ŗ$\frac{VL}{22.4L/mol}$”Į4=1000”Į£Ø5-3£©”Į0.4mol£¬½āµĆV=4480L£¬
¹Ź“š°øĪŖ£ŗ4480£®
µćĘĄ ±¾Ģāæ¼²éµē¹¤ŅµÉś²śÖŠ»ÆѧŌĄķĪüŹÕSO2ŗĶNOµÄ¹¤ŅÕ£¬ĪŖøßĘµæ¼µć£¬²ąÖŲ·ÖĪö”¢¼ĘĖćÄÜĮ¦µÄ漲飬ĢāÄæÉę¼°Ńõ»Æ»¹Ō·“Ó¦”¢Ąė×ÓÅØ¶Č±Č½Ļ”¢µē»ÆѧµČ£¬×ŪŗĻŠŌĒ棬ĢāÄæÄŃ¶Č½Ļ“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
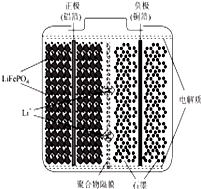 ļ®Ąė×Óµē³Ų¹ć·ŗÓ¦ÓĆÓėČÕ³£µē×Ó²śĘ·ÖŠ£¬Ņ²ŹĒµē¶ÆĘū³µ¶ÆĮ¦µē³ŲµÄŹ×Ń”£®Õż¼«²ÄĮĻµÄŃ”Ōń¾ö¶ØĮĖļ®Ąė×Óµē³ŲµÄŠŌÄÜ£®Į×ĖįŃĒĢśļ®£ØLiFePO4£©ŅŌĘäøß±¶ĀŹŠŌ”¢øß±ČÄÜĮ攢øßŃ»·ĢŲÕ÷”¢øß°²Č«ŠŌ”¢µĶ³É±¾”¢»·±£µČÓŵć¶ųÖš½„³ÉĪŖ”°ÄÜŌ“ŠĀ³Ź”±£®
ļ®Ąė×Óµē³Ų¹ć·ŗÓ¦ÓĆÓėČÕ³£µē×Ó²śĘ·ÖŠ£¬Ņ²ŹĒµē¶ÆĘū³µ¶ÆĮ¦µē³ŲµÄŹ×Ń”£®Õż¼«²ÄĮĻµÄŃ”Ōń¾ö¶ØĮĖļ®Ąė×Óµē³ŲµÄŠŌÄÜ£®Į×ĖįŃĒĢśļ®£ØLiFePO4£©ŅŌĘäøß±¶ĀŹŠŌ”¢øß±ČÄÜĮ攢øßŃ»·ĢŲÕ÷”¢øß°²Č«ŠŌ”¢µĶ³É±¾”¢»·±£µČÓŵć¶ųÖš½„³ÉĪŖ”°ÄÜŌ“ŠĀ³Ź”±£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
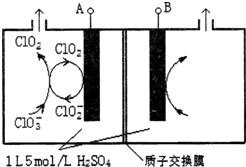 ¶žŃõ»ÆĀČ£ØClO2£©ŹĒ¹śÄŚĶā¹«ČĻµÄøߊ§”¢¹ćĘ×”¢æģĖŁ”¢°²Č«ĪŽ¶¾µÄɱ¾śĻū¶¾¼Į£¬±»³ĘĪŖ”°µŚ4“śĻū¶¾¼Į”±£®¹¤ŅµÉĻæɲÉÓĆĀČĖįÄĘ£ØNaClO3£©»ņŃĒĀČĖįÄĘ£ØNaClO2£©ĪŖŌĮĻÖʱøClO2£®
¶žŃõ»ÆĀČ£ØClO2£©ŹĒ¹śÄŚĶā¹«ČĻµÄøߊ§”¢¹ćĘ×”¢æģĖŁ”¢°²Č«ĪŽ¶¾µÄɱ¾śĻū¶¾¼Į£¬±»³ĘĪŖ”°µŚ4“śĻū¶¾¼Į”±£®¹¤ŅµÉĻæɲÉÓĆĀČĖįÄĘ£ØNaClO3£©»ņŃĒĀČĖįÄĘ£ØNaClO2£©ĪŖŌĮĻÖʱøClO2£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌČÜŅŗÖŠæĻ¶Ø²»ŗ¬Fe2+”¢NO3-”¢SiO32-”¢I- | |
| B£® | ŌČÜŅŗÖŠæĻ¶Øŗ¬ÓŠK+”¢Fe3+”¢Fe2+”¢NO3-”¢SO42- | |
| C£® | ²½Öč¢ņÖŠĪŽÉ«ĘųĢåŹĒNOĘųĢ壬ĪŽCO2ĘųĢå²śÉś | |
| D£® | ĪŖČ·¶ØŹĒ·ńŗ¬ÓŠCl-æÉČ”ŌČÜŅŗ¼ÓČė¹żĮæĻõĖįŅųČÜŅŗ£¬¹Ū²ģŹĒ·ń²śÉś°×É«³Įµķ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÄĘÓėĖ®·“Ó¦£ŗNa+2H2OØTNa++2OH-+H2”ü | |
| B£® | Įņ»ÆĒāĘųĢåĶØČėĀČ»ÆŃĒĢśČÜŅŗ£ŗS2-+Fe2+ØTFeS”ż | |
| C£® | ½«ĀČĘųĶØČėĀČ»ÆŃĒĢśČÜŅŗ£ŗ2Fe2++Cl2ØT2Fe3++2Cl- | |
| D£® | ½šŹōĀĮČÜÓŚĒāŃõ»ÆÄĘČÜŅŗ£ŗAl+2OH-ØTAlO${\;}_{2}^{-}$+H2”ü |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com