
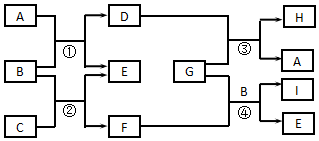
分析 ①焰色反应为紫色说明A中含有钾离子;
②8种离子中能够与铁粉反应的离子为铁离子;
③与硝酸银生成沉淀的离子为OH-、CO32-、Cl-,能够产生气体为碳酸根离子;
④题中离子能够与硫酸根产生沉淀的离子为钡离子,以此解答该题.
解答 解:(1)根据以上分析,A为K2CO3,C为BaCl2,
故答案为:K2CO3;BaCl2;
(2)B中阳离子为铁离子,向溶液中滴入KSCN溶液呈红色,说明含Fe3+,
故答案为:KSCN;溶液变红.
点评 本题考查无机物的推断,为高考常见题型,题目难度不大,注意明确常见离子的反应现象,试题综合性强,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含碳质量分数最大的有机物 | |
| B. | 最简单的有机物 | |
| C. | 是天然气的主要成分 | |
| D. | 与氯气在光照条件下能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键存在于分子之间 | |
| B. | 化学键存在于分子内部 | |
| C. | 化学键是一种作用力 | |
| D. | 化学键可以是原子间作用力,也可以是离子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液中一定存在Mg2+和SO42- | |
| B. | 一定不存在Fe2+、Ba2+和CO32- | |
| C. | Cl-可能存在 | |
| D. | 必须通过焰色反应来确定溶液中是否存在K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com