
分析 (1)FeCl3蚀刻铜箔反应生成氯化亚铁、氯化铜;鼓入空气时氢氧化亚铁被氧化生成氢氧化铁;
(2)氧化铝与NaOH反应生成偏铝酸钠和水;
(3)氨气催化氧化生成NO;用Na2CO3溶液吸收NO和NO2(两种气体体积之比1:1),可生成CO2和一种盐,由氧化还原反应原理可知生成盐为NaNO2,N元素的化合价为+3价,在+2、+4之间,以此来解答.
解答 解:(1)FeCl3蚀刻铜箔反应生成氯化亚铁、氯化铜,离子反应为2Fe3++Cu=2Fe2++Cu2+;鼓入空气时氢氧化亚铁被氧化生成氢氧化铁,发生的反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:2Fe3++Cu=2Fe2++Cu2+;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)氧化铝与NaOH反应生成偏铝酸钠和水,离子反应为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)氨气催化氧化生成NO,反应为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;用Na2CO3溶液吸收NO和NO2(两种气体体积之比1:1),可生成CO2和一种盐,由氧化还原反应原理可知生成盐为NaNO2,N元素的化合价为+3价,在+2、+4之间,离子反应为NO+NO2+CO32-=CO2+2NO2-,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;NO+NO2+CO32-=CO2+2NO2-.
点评 本题考查物质的性质及离子反应、化学反应的书写,为高频考点,把握习题中的信息、氧化还原反应原理、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
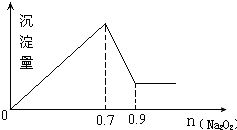 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入Na2O2,得到的沉淀量与加入的Na2O2的关系如图所示,则原溶液中MgCl2、Al2(SO4)3的物质的量浓度之比为( )
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入Na2O2,得到的沉淀量与加入的Na2O2的关系如图所示,则原溶液中MgCl2、Al2(SO4)3的物质的量浓度之比为( )| A. | 1:2 | B. | 2:3 | C. | 6:1 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
| A. | L与Q形成的化合物化学式为LQ | |
| B. | L、M的单质与稀盐酸反应剧烈程度:M>L | |
| C. | Q、T的氢化物在常温常压下均为无色气体 | |
| D. | M的最高价氧化物的水化物不具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷的第一电离能高于磷而电负性低于磷 | |
| B. | 三氯化砷与三氯化氮分子都是三角锥构型 | |
| C. | 最高氧化物对应水化物的化学式为HAsO3 | |
| D. | 砷的第一电离能小于同周期硒的电离能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 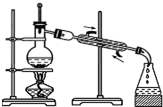 分离沸点相差较大液体混合物 | B. | 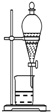 分离互不相溶的两种液体 | ||
| C. | 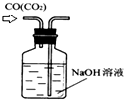 除去CO气体中的CO2气体 | D. | 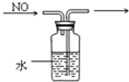 排水集气法收集NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com