
| A. | 常温常压下,0.4g D2气体分子含有的中子数小于0.2NA | |
| B. | 含有0.32g氧元素的二氧化硅中含有的硅氧键数目为0.02NA | |
| C. | 11.2L Cl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA | |
| D. | 7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.2NA |
分析 A、求出重氢的物质的量,然后根据1mol重氢中含2mol中子来分析;
B、求出氧原子的物质的量,然后根据在二氧化硅中,当含2mol氧原子时形成4mol硅氧键来分析;
C、氯气所处的状态不明确;
D、求出过氧化钠的物质的量,然后根据过氧化钠与二氧化硫反应时,过氧化钠中氧元素的价态由-1价变为-2价来分析.
解答 解:A、0.4g重氢的物质的量为n=$\frac{0.4g}{4g/mol}$=0.1mol,而1mol重氢中含2mol中子,故0.1mol重氢中含0.2NA个中子,故A错误;
B、0.32g氧原子的物质的量为n=$\frac{0.32g}{16g/mol}$=0.02mol,而在二氧化硅中,当含2mol氧原子时形成4mol硅氧键,故当含0.02mol氧原子时,含有的硅氧键的条数为0.04NA条,故B错误;
C、氯气所处的状态不明确,故其物质的量无法求算,则转移的电子数无法求算,故C错误;
D、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠与二氧化硫反应时,过氧化钠做氧化剂,氧元素的价态由-1价变为-2价,故0.1mol过氧化钠转移0.2mol电子即0.2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:解答题
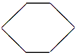 .
.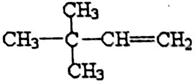 或
或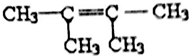 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
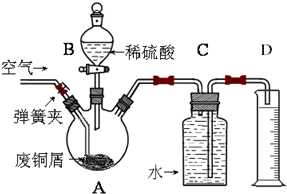
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
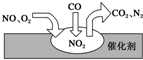 2012年中国汽车销量大幅增长,同时也带来了严重的空气污染.汽车尾气装置中,气体在催化剂表面吸附与解吸的过程如图所示,下列说法正确的是( )
2012年中国汽车销量大幅增长,同时也带来了严重的空气污染.汽车尾气装置中,气体在催化剂表面吸附与解吸的过程如图所示,下列说法正确的是( )| A. | 反应中NO为氧化剂,N2为氧化产物 | |
| B. | 汽车尾气的主要污染成分包括CO、NO和N2 | |
| C. | NO和O2必须在催化剂表面才能反应 | |
| D. | 催化转化总反应为2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$4CO2+N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
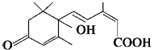 分子式为C15H20O4;
分子式为C15H20O4; 分子式C11H16
分子式C11H16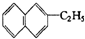 属于萘的同系物,则萘和萘的同系物分子组成通式CnH2n-12(n≥10)
属于萘的同系物,则萘和萘的同系物分子组成通式CnH2n-12(n≥10)
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将过量的Zn投入一定量的浓H2SO4中,最终生成的气体只有SO2 | |
| B. | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | |
| C. | 向50mL12mol•L-1的浓硝酸中加入足量铜片其充分反应,生成0.3molNO2 | |
| D. | 运输保存浓硫酸的槽罐车一旦泄露后应立即用大量水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
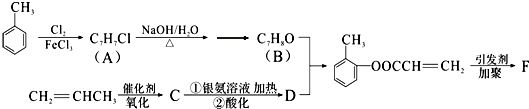
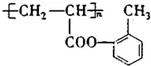
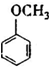 (填结构简式).
(填结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com