
分析 Pd中加入王水的反应可以表示为Pd+HCl+HNO3→A+B↑+H2O(未配平),其中B为无色有毒气体,该气体在空气中不能稳定存在,则B是一氧化氮;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%,剩余的是氯元素,根据各元素的质量分数确定其原子个数比,从而确定其化学式.
解答 解:Pd中加入王水的反应可以表示为Pd+HCl+HNO3→A+B↑+H2O(未配平),其中B为无色有毒气体,该气体在空气中不能稳定存在,则B是一氧化氮;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%,根据元素守恒知剩余的是氯元素,Pd原子、氢原子和氯原子个数比=$\frac{42.4%}{106.4}$:$\frac{0.8%}{1}$:$\frac{1-42.4%-0.8%}{35.5}$=1:2:4,所以A的化学式为:H2PdCl4,
故答案为:H2PdCl4.
点评 本题考查无机物推断,属于计算型推断,涉及化学方程式与化学式有关计算,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CH3CH3+Cl2$\stackrel{光}{→}$CH3CH2Cl+HCl | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | 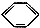 +Br2$\stackrel{Fe}{→}$ +Br2$\stackrel{Fe}{→}$ Br+HBr Br+HBr | |
| D. | CH2═CH2+Br2→CH2Br-CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =$\frac{ax}{2}$mol,n(Cl2)=(1-x)a.
=$\frac{ax}{2}$mol,n(Cl2)=(1-x)a.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X是SO2,它既有氧化性又有还原性 | |
| B. | 干燥的气体Y不能使干燥的有色布条褪色,其水溶液具有漂泊作用的是HClO | |
| C. | Z与水反应的化学方程式为:3NO2+H2O=2HNO3+NO | |
| D. | 等物质的量的X与Y同时通入到湿润的有色布条上,有色布条褪色时间变短,漂泊效果增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯与HBr加成得到的两种产物,无论通过核磁共振氢谱的吸收峰个数、还是峰面积之比,都可以进行区分 | |
| B. | 实验室制乙炔并探究其性质,需首先通过氢氧化钠,以去除去其中混有的硫化氢、磷化氢等酸性气体 | |
| C. | 利用溴乙烷的消去反应来制乙烯,并探究乙烯与高酸钾溶液反应的情况,需先通过水,防止其中可能混有的乙醇蒸汽干扰 | |
| D. | 乙酸、乙醇酯化反应实验:①使用浓硫酸做催化剂、吸水剂,②加热,及时蒸出乙酸乙酯,③适当过量的乙醇,都是在实验室条件下提高乙酸乙酯产率的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图1是盛硫酸的试剂瓶上的标签的部分内容,现实验需要0.5mol•L-1H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
如图1是盛硫酸的试剂瓶上的标签的部分内容,现实验需要0.5mol•L-1H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com