
【题目】化合物H(4-苯基-2-丁酮)是一种重要的医药中间体。以下是合成H的一种路线:
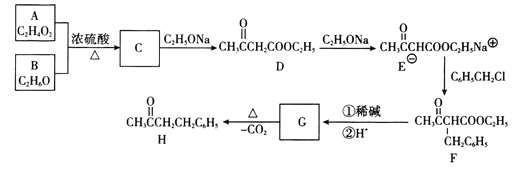
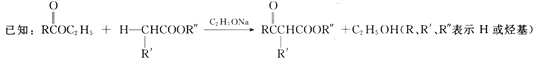
回答下列问题:
(1)A的化学名称为__________________。
(2)D中官能团的名称为___________,E→F的化学反应类型为___________________。
(3)G的结构简式为________________________。
(4)写出C→D的化学反应方程式:__________________________________________。
(5)H存在多种同分异构体,满足下列条件的同分异构体共___________种,其中核磁共振氢谱有5组峰,峰面积比为6:2:2:1:1的结构简式为__________________________。
①含有苯环且只有一个支链;②能发生银镜反应
(6)结合信息,写出用乙酸乙酯为原料制备化合物丙酮(CH3COCH3)的合成路线:___________________________________________________________(其他试剂任选)。
【答案】 乙酸 酯基、羰基 取代反应 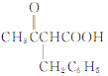
![]()
![]() 5
5 
![]()
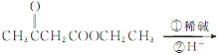
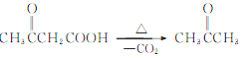
【解析】根据已知条件,结合流程图C→D可知,C为CH3COOCH2CH3,则A为CH3COOH,B为CH3CH2OH;F(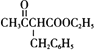 )在碱性溶液中水解后酸化,生成G,则G为
)在碱性溶液中水解后酸化,生成G,则G为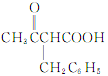 ,G加热发生脱羧反应生成
,G加热发生脱羧反应生成![]() 。
。
(1)根据上述分析,A为CH3COOH,名称为乙酸,故答案为:乙酸;
(2)D(![]() )中官能团为酯基、羰基,根据流程图,E→F发生取代反应生成F(
)中官能团为酯基、羰基,根据流程图,E→F发生取代反应生成F(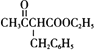 )和氯化钠,故答案为:酯基、羰基;取代反应;
)和氯化钠,故答案为:酯基、羰基;取代反应;
(3)根据上述分析,G为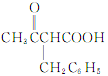 ,故答案为:
,故答案为: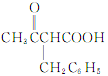 ;
;
(4)根据已知信息, C→D的化学反应方程式为![]()
![]() ,故答案为:
,故答案为:![]()
![]() ;
;
(5)H(![]() )存在多种同分异构体,①含有苯环且只有一个支链;②能发生银镜反应,说明含有醛基,则侧链为—C3H6—CHO,—C3H6—CHO的结构有—CH2CH2CH2CHO、—CH(CH3)CH2CHO、—CH2CH(CH3)CHO、—C(CH3)2CHO、—CH(CH2CH3)CHO共5种,其中核磁共振氢谱有5组峰,峰面积比为6:2:2:1:1的结构简式为
)存在多种同分异构体,①含有苯环且只有一个支链;②能发生银镜反应,说明含有醛基,则侧链为—C3H6—CHO,—C3H6—CHO的结构有—CH2CH2CH2CHO、—CH(CH3)CH2CHO、—CH2CH(CH3)CHO、—C(CH3)2CHO、—CH(CH2CH3)CHO共5种,其中核磁共振氢谱有5组峰,峰面积比为6:2:2:1:1的结构简式为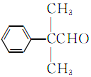 ,故答案为:5;
,故答案为:5; ;
;
(6) 用乙酸乙酯为原料合成丙酮(CH3COCH3),根据程图C→D,可以由乙酸乙酯合成![]() ,然后在碱性溶液中水解后酸化,再脱羧即可,合成路线为
,然后在碱性溶液中水解后酸化,再脱羧即可,合成路线为![]()
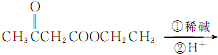
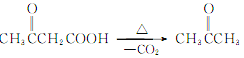 ,故答案为:
,故答案为:![]()
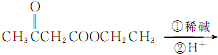
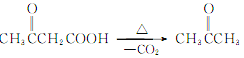 。
。


科目:高中化学 来源: 题型:
【题目】已知20种氨基酸的平均相对分子质量是128,现有一蛋白质分子由两条多肽链组成,共有98个肽键,此蛋白质的相对分子质量最接近于( )
A. 12800 B. 12544 C. 11036 D. 12288
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法。某实验兴趣小组将无水FeC13与氯苯混合发生反应:2FeCl3+C6H5Cl![]() 2FeC12+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeC13的转化率,同时得到常用的还原剂FeC12。按照如图装置,在三颈烧瓶中放入162.5g无水FeC13与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
2FeC12+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeC13的转化率,同时得到常用的还原剂FeC12。按照如图装置,在三颈烧瓶中放入162.5g无水FeC13与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
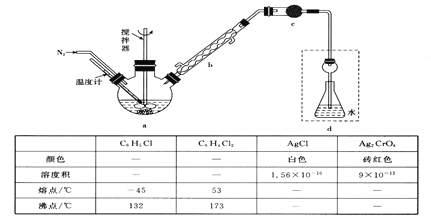
回答下列问题:
(1)仪器c的名称是_______________,盛装的试剂是___________________。
(2)仪器b球形冷凝管的作用是_________________________________。
(3)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是____________(填序号)。
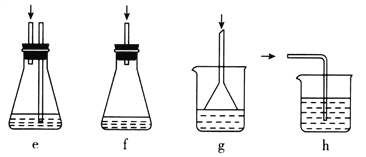
(4)如何从滤液中回收过量的氯苯:_______________________________________。
(5)将锥形瓶内的溶液稀释至1000mL,从中取10.00mL,滴加几滴K2CrO4作指示剂,用0.2000mol·L-1AgNO3溶液进行滴定,当达到终点时,消耗22.50mL AgNO3溶液。
①滴定终点的现象是________________________,使用棕色滴定管进行滴定的原因是________________________________________。
②无水FeC13的转化率![]() =__________%。
=__________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸的组成用H2C2O4表示,为了测定某草酸溶液的浓度,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amolL﹣1的KMnO4溶液滴定到KMnO4不再褪色为止,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.
试回答:
(1)实验中,标准液KMnO4溶液应装在_____式滴定管中,因为______________.
(2)实验中眼睛注视_____________________,直至滴定终点.判断到达终点的现象是_________.
(3)实验中,下列操作(其它操作均正确),会对所测草酸浓度有什么影响?(填偏大、偏小、无影响)
A. 滴定前仰视刻度,滴定后俯视刻度_________.
B. 锥形瓶在盛放待测液前未干燥,有少量蒸馏水_________.
C. 滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧,发生2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性:CO2>MgO,还原性:Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴含丰富的资源,对海水进行综合利用,可制备一系列物质(见下图),下列说法正确的是( )

A. 步骤①中,除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸→过滤
B. 步骤②中反应利用的原理是:相同条件下NaHCO3的溶解度比NaCl小
C. 步骤③在工业上通过向母液中加NaOH固体实现
D. 步骤④利用了Br2的挥发性、还原性,该步的作用是富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年在全球肆虐的禽流感又称为真性鸡瘟,包括中国在内的一些国家和地区发生了人类因感染禽流感病毒死亡的病例。据专家分析,该病毒中有70%-75%的化学成分为蛋白质,因此要重视高温杀毒.在56℃时加热30分钟,60℃时加热10分钟,70℃加热几分钟,阳光直射40-48小时均可杀死禽流感病毒。专家的上述建议是利用了蛋白质性质中的
A. 盐析 B. 变性 C. 水解 D. 颜色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是( )
A. 所占的体积由大到小的顺序是: H2>CH4>O2>CO2>SO2
B. 所含的电子数由多到少是:CO2>SO2>CH4>O2>H2
C. 密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
D. 所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)![]() N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 0.100 | 0.076 | 0.060 | 0.060 | 0.050 | 0.050 |
N2 | 0 | 0.012 | 0.020 | 0.020 | 0.025 | 0.025 |
CO2 | 0 | 0.012 | 0.020 | 0.020 | 0.011 | 0.011 |
(1
(2)30s后,改变某一条件,反应重新达到平衡,则改变的条件可能是________,若30s后升高温度至T2℃,平衡时,容器中NO的浓度由0.060mol/L变为0.072mol/L,则该反应的a___0 (填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com