
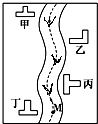
 在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示).它们所排出的废液里每厂只含有NaHCO3、FeCl3、Ca(OH)2、HCl中的一种.某环保小组对河水监测时发现
在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示).它们所排出的废液里每厂只含有NaHCO3、FeCl3、Ca(OH)2、HCl中的一种.某环保小组对河水监测时发现分析 由图及①②可知,甲排放的为Ca(OH)2,乙排放的为FeCl3,由③浑浊变清可知,丙排放的HCl,丁工厂所在河水段产生气泡,河水仍清,可知丁排放的为NaHCO3,以此来解答.
解答 解:由图及①②可知,甲排放的为Ca(OH)2,乙排放的为FeCl3,由③浑浊变清可知,丙排放的HCl,丁工厂所在河水段产生气泡,河水仍清,可知丁排放的为NaHCO3,
(1)由上述分析可知,甲:Ca(OH)2,乙:FeCl3,丙:HCl,丁:NaHCO3,故答案为:Ca(OH)2;FeCl3;HCl;NaHCO3;
(2)甲、丁两工厂的排水口收集等体积等物质的量浓度的澄清透明废液进行混合,反应的离子方程式Ca2++HCO3-+OH-=CaCO3↓+H2O,
故答案为:Ca2++HCO3-+OH-=CaCO3↓+H2O;
(3)乙排放的为FeCl3,三氯化铁会水解,加热,水解产生的氯化氢逸出促进水解,蒸干后得到的是氢氧化铁,则不能直接蒸干乙厂废水得到,
故答案为:否;三氯化铁会水解,加热,水解产生的氯化氢逸出促进水解,蒸干后得到的是氢氧化铁.
点评 本题考查无机物的推断,为高频考点,把握物质之间的反应与现象、盐类水解、与量有关的反应为解答的关键,侧重分析与推断能力的考查,注意元素化合物的应用,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在偏二甲肼与四氧化二氮的反应中,N2O4是氧化剂 | |
| B. | 两物质反应时,生成的无毒气体为CO2、N2、和H2O | |
| C. | 偏二甲肼中N元素的化合价均为-2价 | |
| D. | 偏二甲肼的同分异构体中,含碳碳单键的化合物只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- | |
| B. | 在由水电离出的c(H+)=1×10-12mol/L的溶液:Fe3+、ClO-、Na+、SO42- | |
| C. | 加入金属铝产生H2的溶液中:Na+、K+、SO42-、Cl- | |
| D. | 饱和氯水中:Cl-、Na+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
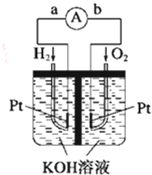 燃料电池是符合绿色化学理念的新型发电装置.如图为氢氧燃料电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
燃料电池是符合绿色化学理念的新型发电装置.如图为氢氧燃料电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
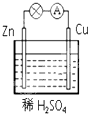 在如图所示的锌铜原电池中,Zn作原电池的负极,电极上发生的是氧化反应(填“氧化”或“还原”),该电极反应式为Zn-2e-=Zn2+,观察到的现象为锌片溶解;Cu作原电池的正 极,电极上发生的是还原反应(填“氧化”或“还原”),该电极反应式为2H++2e-=H2↑,观察到的现象为铜片上有气泡产生.
在如图所示的锌铜原电池中,Zn作原电池的负极,电极上发生的是氧化反应(填“氧化”或“还原”),该电极反应式为Zn-2e-=Zn2+,观察到的现象为锌片溶解;Cu作原电池的正 极,电极上发生的是还原反应(填“氧化”或“还原”),该电极反应式为2H++2e-=H2↑,观察到的现象为铜片上有气泡产生.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.93 g | B. | 5.85 g | C. | 6.56g | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com