
| A、Na2O2和H2O |
| B、Na和O2 |
| C、NaOH和CO2 |
| D、NaOH和AlCl3 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
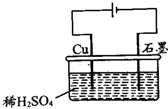
| A、电解过程中,铜电极上有氢气生成 | ||||
B、电解初期,主反应为:Cu+H2SO4
| ||||
| C、电解过程中,铜电极不断变细 | ||||
| D、整个电解过程中,H+的浓度不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
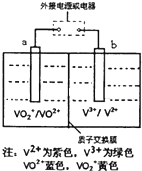 某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性.充电时右槽溶液颜色由绿色变为紫色.下列叙述正确的是( )
某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性.充电时右槽溶液颜色由绿色变为紫色.下列叙述正确的是( )| A、充电时,b极接直流电源正极,a极接直流电源负极 |
| B、充电过程中,a极的电极反应式为:VO2++2H++e-=VO2++H2O |
| C、放电时,H+从左槽迁移进右槽 |
| D、放电过程中,左槽溶液颜色由黄色变为蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12g石墨烯(单层石墨)中含有六元环的个数为0.5N0 |
| B、1.0 L 1.0mol?L-1的NaAlO2水溶液中含有的氧原子数为2N0 |
| C、25℃时pH=13的NaOH溶液中含有OH-的数目为0.1N0 |
| D、1mol的羟基与1mol的氢氧根离子所含电子数均为9N0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Cl2作为氧化剂得到的电子数为NA |
| B、在常温常压时,22.4L氢气中含有2NA个氢原子 |
| C、标准状况下,22.4L CH3Cl中含有的氯原子数目是NA |
| D、NA个一氧化碳分子和0.5 mol 甲烷的质量比为7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧气的摩尔质量是32g |
| B、1mol二氧化碳的质量为44g?mol-1 |
| C、O2的摩尔质量(单位是g?mol-1)在数值上等于其相对分子质量 |
| D、不同物质的摩尔质量一定不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(I-)/mol?L-1 | c(Fe3+)/mol?L-1 | v/mol?L-1?s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com