
| A. | 苯分子中的6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间独特的键 | |
| B. | 将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应 | |
| C. | 乙烷和丙烯的物质的最共1mol,完全燃烧后生成3molH2O | |
| D. | 主链上有5个碳原子的庚烷有5 种同分异构体 |
分析 A.苯分子具有平面正六边形结构,苯分子含有一种特殊的化学键,键长介于C-C和C═C之间;
B.苯和溴水不反应;
C.乙烷和丙烯含有的H原子数相同;
D.主链上有5个碳原子的庚烷,支链可为甲基或乙基.
解答 解:A.苯分子含有一种特殊的化学键,键长介于C-C和C═C之间的独特的键,故A正确;
B.苯和溴水不反应,因溴易溶于苯,溴水变浅为萃取原因,故B错误;
C.乙烷和丙烯含有的H原子数相同,则乙烷和丙烯的物质的最共1mol,完全燃烧后生成3molH2O,故C正确;
D.主链上有5个碳原子的同分异构体有:2,3-二甲基戊烷,2,4-二甲基戊烷,2,2-二甲基戊烷,3,3-二甲基戊烷,3-乙基戊烷,共5种,故D正确.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握有机物的结构和性质,难度不大.


科目:高中化学 来源: 题型:选择题
| 不纯物质 | 除杂试剂 | 分离方法 | |
| A | 苯(甲苯) | KMnO4(酸化),NaOH溶液 | 分液 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 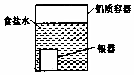 用如图装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-═2Ag+S2- | |
| B. | 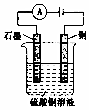 如图装置电解一段时间后,铜电极部分溶解,溶液中通离子的浓度基本不变 | |
| C. | 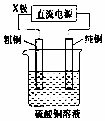 如图装置中若直流电源的X极为负极,则该装置可实现粗铜的电解精炼 | |
| D. | 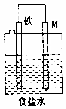 如图,图中若M是铜,则该装置能防止铁被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | Fe2+、Na+、SO42-、Cl- | 碘水 | 2Fe2++I2═2Fe3++2I- |
| B | pH=8的溶液中:Na+、HCO3-、Cl- | 少量澄清石灰水 | Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
| C | 透明溶液中:NH4+、Fe3+、Cl-、AlO2- | 过量铜粉 | Cu+2Fe═2Fe2++Cu2+ |
| D | K+、Na+、SO42-、ClO- | 少量SO2 | 2Cl-+SO2+H2O═2HClO+SO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3分解 | B. | CO2+OH- | C. | Al+OH-+H2O | D. | Al2O3+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
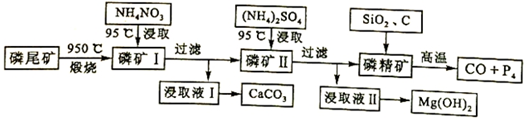
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| H2 | SO2 | H2 | SO2 | ||
| 容器Ⅰ | 300 | 0.3 | 0.1 | / | 0.02 |
| 容器Ⅱ | 300 | 0.6 | 0.2 | / | / |
| 容器Ⅲ | 240 | 0.3 | 0.1 | / | 0.01 |
| A. | 该反应的正反应吸热 | |
| B. | 到达平衡时,容器Ⅰ中SO2的转化率比容器Ⅱ的大 | |
| C. | 240℃时,该反应的平衡常数为1.08×104 | |
| D. | 到达平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
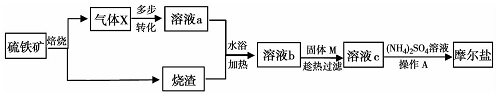
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com