
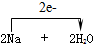 =2NaOH+H2↑.
=2NaOH+H2↑. 分析 (1)有电子转移的化学反应是氧化还原反应,水仅被还原是氧化剂,说明该反应中水中元素化合价只能降低,据此分析解答;
(2)钠和水反应生成氢氧化钠和氢气,钠由0价变为+1价,水中H元素化合价由+1价变为0价,据此分析.
解答 解:(1)A.Cl2+H2O=HCl+HClO,氯元素化合价由0价变为+1价和-1价,水中H、O元素化合价不变,所以水既不是氧化剂也不是还原剂,故A错误;
B.2Na2O2+2H2O═4NaOH+O2↑,Na2O2中O元素化合价由-1价变为0价和-2价,水中H、O元素化合价不变,所以水既不是氧化剂也不是还原剂,故B错误;
C.CaH2+2H2O═Ca(OH)2+2H2↑,该反应水中H元素化合价由+1价变为0价,所以水是氧化剂被还原,故C正确;
D.3Fe+4H2O $\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2,该反应水中H元素化合价由+1价变为0价,所以水是氧化剂被还原,故D正确;
故选CD;
(2)钠和水反应生成氢氧化钠和氢气,钠由0价变为+1价,水中H元素化合价由+1价变为0价,其电子转移方向和数目为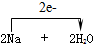 =2NaOH+H2↑,
=2NaOH+H2↑,
故答案为: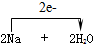 =2NaOH+H2↑.
=2NaOH+H2↑.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题

| A. | 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 由图Ⅱ知,反应在t6时刻,NH3体积分数最大 | |
| C. | 由图Ⅱ知,t3时采取降低反应体系压强的措施 | |
| D. | 图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
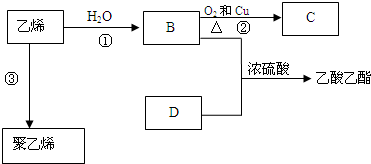
 .
.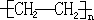 反应类型:加聚反应
反应类型:加聚反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
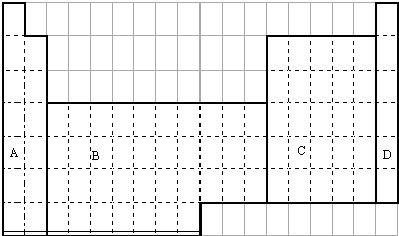
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
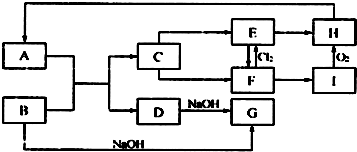

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①④ | B. | ②③ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
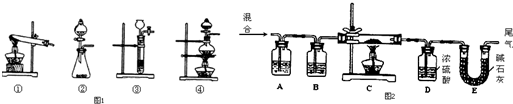
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com