
| A. | 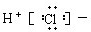 | B. | 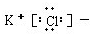 | C. | Cl:Cl | D. | 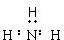 |
分析 A、HCl是通过共用电子对形成的共价化合物,没有阴阳离子.
B、KCl是离子化合物,由K+和Cl-构成.
C、氯原子周围的孤对电子写漏掉了.
D、与C同理,氮原子与氢原子除共用电子对外,还有一对孤对电子没写出.
解答 解:A.HCl是通过共用电子对形成的共价化合物,是H与Cl间有一对共用电子对,写成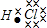 ,故A错误;
,故A错误;
B.氯化钾是离子化合物,钾离子的电子式为K+,氯离子的电子式为 ,所以氯化钾的电子式为
,所以氯化钾的电子式为 ,故B正确;
,故B正确;
C、Cl2是通过共用电子对形成的单质,达到8电子稳定结构,写成 ,故C错误;
,故C错误;
D.NH3中N周围达8电子稳定结构,漏写了一对,写成 ,故D错误.
,故D错误.
故选B.
点评 本题考查电子式的书写,易错.注意判断微粒间是通过得失电子,还是通过共用电子对达到稳定结构的;不要漏掉一些没有产加共用的电子对.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:选择题
 六种元素周期表中的位置如图,其中只有一种不是短周期元素,只有一种是金属元素,下列说法正确的是( )
六种元素周期表中的位置如图,其中只有一种不是短周期元素,只有一种是金属元素,下列说法正确的是( )| A. | 简单离子半径大小:Q>Y>X | |
| B. | 最简单气态氢化物的沸点高低:Y>Z | |
| C. | Q的最高价氧化物可与X的氢化物直接反应 | |
| D. | X与Y既可存在于同一共价化合物中,也可存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 | |
| C. | 氯化氢的沸点比氟化氢的沸点高 | |
| D. | 第三周元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③苯、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③苯、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.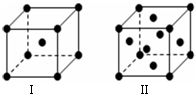
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有4种无色液态物质:己烯、己烷、苯和甲苯.按要求填空:
有4种无色液态物质:己烯、己烷、苯和甲苯.按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 向某溶液中滴入几滴酸性KMnO4溶液,然后滴加KSCN溶液 | 溶液最终变为红色 | 原溶液中含有Fe3+ |
| B | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | KSP(AgCl)>KSP(AgI) |
| C | 用洁净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃观察到火焰颜色为紫色 | 原溶液中一定只含K+ |
| D | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热煮沸 | 未见红色沉淀生成 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5 种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{A}{a}$(N-a) mol | B. | $\frac{a}{A+n}$(n+A)mol | C. | $\frac{A}{a+n}$(N+n) mol | D. | $\frac{a}{A+n}$(A-N+n) mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com