
| A����ͬ�¶��£�������Һ�е�Ag+Ũ�ȣ�AgCl��Ag2CrO4��AgI |
| B����ʳ��ˮ�м�AgNO3���γ�AgCl����ʱ����Һ�е�Ag+Ũ��Ϊ1.34��10-5 mol?L-1 |
| C����AgI���������Һ�У���μ��뱥��ʳ��ˮ��ԭ��������ɰ�ɫ |
| D����Cl-��I-��CrO42-Ũ�Ⱦ�Ϊ0.010 mol?L-1����Һ�У���μ���AgNO3��Һ�������γ�Ag2CrO4���� |
| 1 |
| 2 |
| 1.56��10-10 |
| 0.01 |
| 1.56��10-16 |
| 0.01 |
|
|


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ����̿ |
| 400�� |
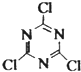 �����й�˵����ȷ���ǣ�������
�����й�˵����ȷ���ǣ�������| A������������C1�Ļ��ϼ���+1 |
| B���÷�Ӧ��NaCN����ԭ |
| C��������������мȺ��Ҽ��ֺ��н� |
| D��36.9 g���������к���1.204��1023��ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ȥNO�л��е�NO2�����������ͨ������ˮ��Ȼ����CaCl2���� |
| B������һ�����ʵ���Ũ�ȵ�Fe��NO3��2��Һ����һ������Fe��NO3��2���������������У��ټ���ˮϡ����ָ��Ũ�� |
| C������������ʯ��ˮ�м�����CaO���ָ������º���ҺpH��� |
| D����ҵ�Ϸքe�õ������Al2O3��MgO��NaCl�ķ�����ȡAl��Mg��Na |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 6�����ڶ���������Ԫ�ص����λ�����±���MԪ��ԭ�Ӻ����������YԪ��ԭ�Ӻ����������2����WԪ��ԭ�ӵĴ�����������������������2�����û�ѧ����ش��������⣺
6�����ڶ���������Ԫ�ص����λ�����±���MԪ��ԭ�Ӻ����������YԪ��ԭ�Ӻ����������2����WԪ��ԭ�ӵĴ�����������������������2�����û�ѧ����ش��������⣺| X | Y | Z | |
| W | M | Q |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c(H+) |
| c(OH-) |
| c(H+) |
| c(HA) |
| c(HA) |
| c(A) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������������ˮ��������ɱ�� |
| B����ʯ�ҡ����ۣ��轺��ʳƷ��װ�г��õĸ���� |
| C���������ֿ���ʳƷ�ı��ʼ� |
| D���������������������ά |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
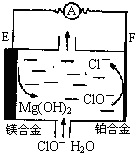 þȼ�ϵ���ڿ��ƶ������豸��Դ�ͱ��õ�Դ�ȷ���Ӧ��ǰ����������ͼΪ��þһ�������Ρ�ȼ�ϵ��ʾ��ͼ���缫Ϊþ�Ͻ�Ͳ��Ͻ𣮹��ڸõ�ص�������ȷ���ǣ�������
þȼ�ϵ���ڿ��ƶ������豸��Դ�ͱ��õ�Դ�ȷ���Ӧ��ǰ����������ͼΪ��þһ�������Ρ�ȼ�ϵ��ʾ��ͼ���缫Ϊþ�Ͻ�Ͳ��Ͻ𣮹��ڸõ�ص�������ȷ���ǣ�������| A��EΪ��ȼ�ϵ�ص����� |
| B�����������ĵ缫��ӦʽΪClO-+2e-+H2O=Cl-+2OH- |
| C����ع���ʱ��������Χ��Һ��pH�����ϱ�С |
| D��þȼ�ϵ�ظ����ܷ����Ը�ʴ����������ʹ���������ʽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��200mL1molAl2��SO4��3��Һ�У�Al3+��SO42-���������ܺ�ΪNA |
| B����״���£�2.24L�Ҵ��к��е�C-H����ĿΪ0.5NA |
| C��0.1molNa��ȫ����������Na2O2��ת�Ƶ��ӵ���ĿΪ0.1NA |
| D��0.1molO2��O3�Ļ�������к���ԭ����ĿΪ0.2NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com