
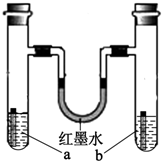
 如图装置中,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一块生铁片,放置一段时间.下列有关描述错误的是( )
如图装置中,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一块生铁片,放置一段时间.下列有关描述错误的是( )| A、两块生铁片均发生电化学腐蚀 |
| B、墨水柱两边的液面变为左低右高 |
| C、两试管中相同的电极反应式为Fe-2e-=Fe2+ |
| D、a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |


科目:高中化学 来源: 题型:
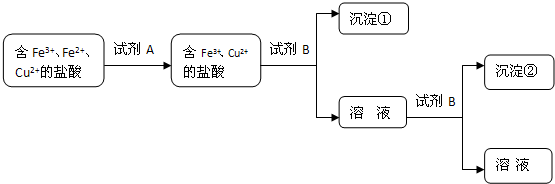
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.0 | 3.0 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、③⑥⑦ |
| C、②⑤⑦ | D、①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池外壳的金属材料回收再利用 |
| B、将地沟油回收再加工为食用油,提高资源的利用率 |
| C、目前我国使用的主要能源是化石燃料,化石燃料属于不可再生能源 |
| D、能源的开发和利用情况,可以衡量一个国家或地区的经济发展和科学技术水平 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.5mol?L-1氨水中所含NH4+数为0.5NA |
| B、1mol Fe与足量氯气反应转移的电子数为2 NA |
| C、标准状况下,33.6L CO2约含有1.5NA个分子 |
D、1 mol  中含碳碳双键数为3 NA 中含碳碳双键数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO42-+2OH-+Ba2+═BaSO4↓+Cu(OH)2↓ |
| B、氯化铝溶液中加入过量的氨Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| C、氯化钙与碳酸氢钾溶液混合:Ca2++CO32-═CaCO3↓ |
| D、小苏打与氢氧化钠溶液混合:HCO3-+OH-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某化合物溶于水导电,则该化合物为电解质 |
| B、NaCl溶液在电流作用下电离成Na+和Cl- |
| C、在氧化还原反应中,非金属单质一定是氧化剂 |
| D、元素由化合态变成游离态时,它可能被氧化,也可能被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
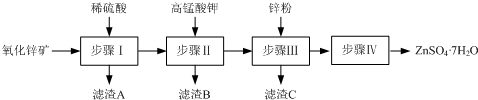
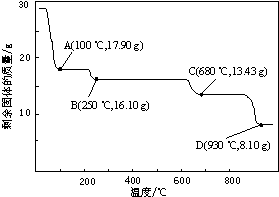
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com