
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)元素⑨的基态原子的价电子排布式为_________________。
(2)这10种元素,其中电负性最大的是________(填元素符号)。
(3)元素②的一种氢化物(分子中含有6个原子)是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是________。
A.6个原子不在同一平面上 B.属于含有极性键的非极性分子
C.只含有4个sp2-s的δ键和1个P-P的π键 D.该氢化物分子中C原子采用sp2杂化
(4)下图所示为血红蛋白和肌红蛋白的活性部分(血红素)的结构式。此结构片段中含有的化学键有________(填序号)。

A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 G. δ键 H.兀键
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。

请回答:表中的D、E、F可能是哪三种元素__________(填元素符号);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的认识正确的是( )
A.第一张元素周期表是美国化学家门捷列夫制成的
B.门捷列夫制定的第一张元素周期表是按照核电荷数由小到大的顺序排列的
C.目前使用的元素周期表是按照原子序数由小到大的顺序排列的
D.同周期元素的原子结构示意图的最外层电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在中和滴定实验中记录数据见下表。因为时间紧迫,只做了两次实验。
第一次滴定 | 第二次滴定 | |
待测液HCl的体积/mL | 20.00 | 20.00 |
滴定终点消耗标准液NaOH的体积/mL | 23.20 | 26.00 |
该同学测得待测液HCl物质的量浓度 ( )
A.0.2088mol/LB.0.2250mol/LC.0.2169 mol/LD.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应C(s)+H2O(g)![]() CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
①增加C的物质的量 ②保持体积不变,充入N2使体系压强增大 ③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
A. ①② B. ②③ C. ①④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某课外活动小组同学用如图装置进行实验,试回答下列问题:
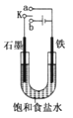
①若开关K与a连接,则铁发生电化学腐蚀中的_____腐蚀,石墨电极上的电极反应式为_____。
②若开关K与b连接,则电解反应的化学方程式为_____。
(2)该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如下图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
①该电解槽的阳极反应式为_____。
此时通过阴离子交换膜的离子数_____(选填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
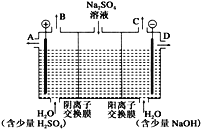
②通电开始后,阴极附近溶液pH_____(选填“增大”、“不变”或“减小”)。
③若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为_____;已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g 液态H2O时,理论上有_____kJ的能量转化为电能。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
A. 反应在前50 s 的平均速率ν(PCl3)= 0. 0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)= 0. 11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1. 0 mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2,反应达到平衡前ν(正)>ν(逆)
D. 相同温度下,起始时向容器中充入2. 0 mol PCl3 和2. 0 mol Cl2,达到平衡时,PCl3 的转化率大于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物H是一种光刻胶,其中的一种合成路线如下:

回答下列问题:
(1)B的化学名称是_________。
(2)B生成C的反应类型为_________,F与G反应生成H的反应类型为_________。
(3)H中官能团的名称为___________________________。
(4)C的结构简式为__________________,G的结构简式为__________________。
(5)已知E与D,F与CH3OH分别含有相同的官能团,写出D与CH3OH反应生成E和F的化学方程式:________。
(6)芳香族化合物X是G的同分异构体,1 mol X与足量银氨溶液反应生成4 mol Ag,则X的结构简式有_____(不考虑立体异构)种,写出核磁共振氢谱显示有五种不同化学环境的氢,且峰面积之比为1:2:2:2:1的X的结构简式:___________(任写一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com