
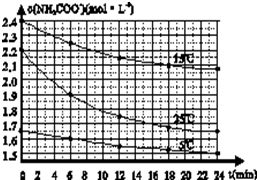
 某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O?NH4HCO3+NH3?H2O,经测得c(NH2COO-)与反应时间的关系如图所示.据图判断下列说法正确的是( )
某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O?NH4HCO3+NH3?H2O,经测得c(NH2COO-)与反应时间的关系如图所示.据图判断下列说法正确的是( )| A、0~12 min,初始浓度越大的实验,水解反应速率越大 |
| B、c(NH2COO-)将随反应时间的不断延长而一直减小至0 |
| C、25℃时0~6 min,v(NH2COO-)为0.05 mol?L-1?min-1 |
| D、15℃时,第30 min时,c(NH2COO-)为2.0 mol?L-1 |
| 1.65mol/L-1.55mol/L |
| 12min |
| 2.2mol/L-1.75mol/L |
| 12min |
| 2.4mo/L-2.15mol/L |
| 12min |
| 2.2mol/L-1.9mol/L |
| 6min |
| 1.65mol/L-1.55mol/L |
| 12min |
| 2.2mol/L-1.75mol/L |
| 12min |
| 2.4mo/L-2.15mol/L |
| 12min |
| 2.2mol/L-1.9mol/L |
| 6min |


科目:高中化学 来源: 题型:
| A、Al3+、Na+、HCO3-、Cl- |
| B、Fe3+、NO3-、Cl-、SO42- |
| C、Na+、H+、SO32-、NO3- |
| D、SiO32-、Na+、K+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有碳、氢两种元素 |
| B、一定含有氧元素 |
| C、该物质为有机化合物 |
| D、氢元素的质量分数为20% |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当温度升高时,弱酸的电离平衡常数Ka变小 |
| B、某温度下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol/L |
| C、由Ksp(AgCl)>Ksp(AgI)可判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能发生 |
| D、常温下,pH=12氨水与pH=2盐酸等体积混合c(Cl-)>c(NH+4)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去 CO2 中混有的 CO:用澄清石灰水洗气 |
| B、除去 BaCO3 固体中混有的 BaSO4:加过量盐酸后,过滤、洗涤 |
| C、除去 FeCl2 溶液中混有的 FeCl3:加入过量铁粉,过滤 |
| D、除去 Cu 粉中混有的 CuO:加适量稀硝酸后,过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于合金中金属的活泼性不同所以合金都易生锈 |
| B、进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C、配制FeCl3溶液时,应将FeCl3溶解在适量的HCl中 |
| D、酸碱中和滴定时,锥形瓶需用待测液润洗2遍,再加入待测液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com