
| A�� | �٢ڢ� | B�� | �ڢۢ� | C�� | �٢ڢ� | D�� | �٢ڢ� |
���� ���ֵ��롢��Һ�д��ڵ���ƽ��ĵ����Ϊ������ʣ�Ҫ֤��������Ϊ������ʣ�ֻҪ֤�������Ჿ�ֵ��뼴�ɣ��ݴ˷������
��� �⣺��0.1mol/L HNO2��Һ��pH=2.1��������Ũ��С��������Ũ�ȣ�˵���������Dz��ֵ��룬Ϊ������ʣ�����ȷ��
�ڳ�����NaNO2��Һ��pH��7��˵������������ǿ�������Σ������������ᣬΪ������ʣ�����ȷ��
����HNO2��Һ������ʵ��ʱ�����ݺܰ���˵������Һ������Ũ�Ƚ�С������˵�������Ჿ�ֵ��룬���Բ���֤����������������ʣ��ʴ���
��HNO2��Һ��KCl��Һ��������Ӧ��˵�������ϸ��ֽⷴӦ����������˵�������Ჿ�ֵ��룬���Բ���֤����������������ʣ��ʴ���
��HNO2����̼���Ʒ�Ӧ��CO2��˵�����������Դ���̼�ᣬ������˵�������Ჿ�ֵ��룬����֤����������������ʣ��ʴ���
��HNO2�ǹ��ۻ��������˵�������Ჿ�ֵ��룬����֤����������������ʣ��ʴ���
�߷ֱ��0.1mol/L HNO2��Һ��0.01mol/L HNO2��Һ��pH���������ߵ�pH���С��1����λ��˵��ϡ��ϡ��������������ڵ���ƽ�⣬��˵����������������ʣ�����ȷ��
��ѡC��
���� ���⿼��ǿ��������жϣ�Ϊ��Ƶ���㣬��ȷǿ������ʸ��������ǽⱾ��ؼ��������ǿ����������Һ������ǿ���أ�Ϊ�״��㣮


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
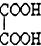
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu2+��Cl-��K+��SO42- | B�� | CO32-��Na+��K+��SO42- | ||
| C�� | Mg2+��Cl-��K+��NO3- | D�� | Ag+��NO3-��K+��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2����NO��=3����H2O�� | B�� | 5����O2��=6����H2O�� | C�� | ����NH3��=����H20�� | D�� | 5����NH3��=4����O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��֪����N2��g��+O2��g��=2NO��g����H1=+180kJ•mol-1
��֪����N2��g��+O2��g��=2NO��g����H1=+180kJ•mol-1| A�� | ��Ӧ���е������仯����ͼ��ʾ�����H2=E1-E3 | |
| B�� | H2��ȼ����Ϊ241.8 kJ•mol-1 | |
| C�� | �ɷ�Ӧ��֪���¶�һ���������£���һ�����ܱ�������ͨ��1 mol N2��3 mol H2����Ӧ��ų�������ΪQ1 kJ����ͨ��2 mol N2��6 mol H2��Ӧ��ų�������ΪQ2 kJ����184.8��Q2��2Q1 | |
| D�� | ���Ĵ�������ӦΪ4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=+906 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Xn-��ԭ�Ӻ���һ���У�A-x-n�������� | |
| B�� | Xn-��ԭ�Ӻ���һ���У�x-n�������� | |
| C�� | Xn-�������һ������8�����ȶ��ṹ | |
| D�� | Xn-�Ĵ����һ���Ų���8������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com