
【题目】下列说法或表示正确的是
A.氯化钠晶体中,每个Na+周围距离相等且紧邻的Na+共有12个
B.酒石酸(HOOC-CHOH-CHOH-COOH)不存在手性碳原子
C.熔点:MgBr2<SiCl4<SiC
D.邻羟基苯甲酸分子内形成了氢键,所以沸点高于对羟基苯甲酸

【答案】A
【解析】
氯化钠晶体中,Na+位于顶点和面心;手性碳原子指与碳相连的4个基团均不一样;晶体的熔沸点通常规律:原子晶体>离子晶体>分子晶体;分子间氢键,物质的熔沸点反常的高,分子内氢键,物质的熔沸点更低。
A.氯化钠晶体中,Na+位于顶点和面心,每个Na+周围距离相等且紧邻的Na+共有12个,故A正确;
B.手性碳原子指与碳相连的个基团均不一样,由酒石酸的结构式可知,中间2个碳原子均是手性碳原子,2号碳上连接的是氢、羟基、羧基、-CHOH-COOH,故B错误;
C.晶体的熔沸点通常规律:原子晶体>离子晶体>分子晶体,MgBr2是离子晶体,SiCl4是分子晶体,SiC是原子晶体,故熔点:SiCl4<MgBr2< SiC,故C错误;
D.邻羟基苯甲酸与对羟基苯甲酸同为分子晶体,相对分子质量一样,互为同分异构体,分子间氢键,物质的熔沸点反常的高,分子内氢键,物质的熔沸点更低,所以沸点:邻羟基苯甲酸<对羟基苯甲酸;
答案选A。


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为 2Ag+Cl2═2AgCl。
(1)写出该电池工作时的两极反应:负极:___;正极:___。
(2)当电路中转移amole﹣时,交换膜左侧溶液中约减少___mol离子;交换膜右侧溶液c(HCl)___(填“>”“<”或“=”)1molL-1(忽略溶液体积变化)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年3月,我国科学家研发出一种新型的锌碘单液流电池,其原理如图所示。下列说法不正确的是
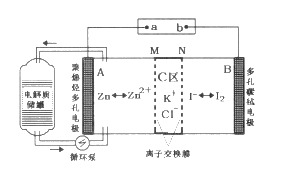
A. 放电时B电极反应式为:I2+2e-=2I-
B. 放电时电解质储罐中离子总浓度增大
C. M为阳离子交换膜,N为阴离子交换膜
D. 充电时,A极增重65g时,C区增加离子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示装置制备一硝基甲苯。
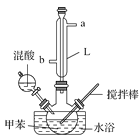
实验步骤如下:
①配制浓硫酸和浓硝酸(按体积比1∶3)的混合物(混酸);
②在三颈瓶里装15 mL甲苯;
③装好其他药品,并组装好仪器;
④向三颈瓶中加入混酸,并不断搅拌;
⑤控制温度,大约反应10分钟至三颈瓶底有大量液体(淡黄色油状)出现;
⑥分离出一硝基甲苯。(已知:甲苯的密度为0.866 g·cm-3,沸点为110.6 ℃;硝基苯的密度为1.20 g·cm-3,沸点为210.9 ℃)
根据上述实验,回答下列问题:
(1)实验方案中缺少一个必要的仪器,它是________。本实验的关键是控制温度在30 ℃左右,如果温度过高,产生的后果是__________________________。
(2)简述配制混酸的方法:________________________________,浓硫酸的作用是_________________。
(3)L仪器名称是________,进水口是________。
(4)写出甲苯与混酸反应生成对硝基甲苯的化学方程式:______________,反应类型为:________。
(5)分离产品方案如下:

操作1的名称是________。
(6)经测定,产品1的核磁共振氢谱中有3个峰,则其结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.己知2C+SiO2![]() Si+2CO↑,说明Si的非金属性比C强
Si+2CO↑,说明Si的非金属性比C强
B.电子层数越多,原子半径一定越大
C.单质中不可能含有离子键
D.第ⅥA族元素的氢化物中,稳定性最强的其沸点最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,有下列五种溶液:A.0.1mol/LNH4Cl B.0.1mol/L CH3COONH4 C.0.1mol/LNH4HSO4 D.0.1mol/LNH4HCO3 E.0.1mol/LNaHCO3
请根据要求填写下列空白:
(1)溶液A呈___性(填“酸”、“碱”或“中”),其原因是:___(用离子方程式表示)。
(2)溶液E呈___性(填“酸”、“碱”或“中”),其原因是:___(用离子方程式表示)。
(3)比较溶液A、C中c(NH4+)的大小关系是A___C(填“>”、“<”或“=”)。
(4)常温下,测得溶液B的pH=![]() ,则CH3COO-的水解程度___NH4+的水解程度(填“>”、“<”或“=”),CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)___c(NH4+)(填“>”、“<”或“=”)。
,则CH3COO-的水解程度___NH4+的水解程度(填“>”、“<”或“=”),CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)___c(NH4+)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列叙述中正确的是
A.溶液中:c(H+)=c(OH-)+c(SO42-)
B.NaHSO4属于酸式盐,加入水中促进水的电离
C.1 mol NaHSO4晶体中含有的离子总数为3NA
D.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CH3COONa溶液里,加入下列物质使水解平衡向左移动,并且pH变大的是 ( )
A. 加入适量纯CH3COOH
B. 加入少量NaCl固体
C. 加入少量NaOH固体
D. 加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡: H2O![]() H++ OH-ΔH > 0 ,下列叙述正确的是
H++ OH-ΔH > 0 ,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 向水中加入少量盐酸,c(H+)增大,Kw不变
C. 向水中加入NaOH固体,平衡逆向移动,c(OH-) 降低
D. 向水中加入AlCl3固体,平衡逆向移动,c(OH-) 增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com